您好,欢迎来到显微镜配件耗材官网!
 最新资讯返回
最新资讯返回声光偏转器(Acousto-opticdeflector, AOD)与它兄弟声光调制器(AOM)、声光可调谐滤波器(AOTF)都属于声光器件,即在声光材料中通过声音(振动)来改变激光的参数。它们已经有八十多年的历史[1],在激光打印机、激光电视、激光加工领域等领域均有应用,近二十年来在激光扫描显微镜领域应用日益增多。
AOD与机械式扫描器工作原理十分不同。机械式扫描器,如检流计镜、多面镜、共振振镜,是通过转动反射镜的角度从而改变激光的方向,原理较简单。而AOD的工作原理是基于发生于声光介质中的声光效应。声光效应可以理解为声波在声光介质中传播时致使介质产生应变,进而使介质的折射率发生相应的变化。由于应变场是平面声波的位置的周期函数,因此介质的折射率变化也是周期函数,类似于一个周期光栅[2]。由于衍射效应,经过声波形成的光栅,激光的方向将发生偏转。AOD原理示意图如图1。偏转角度的大小与“光栅常数”有关,具体表达式是:
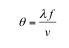 (1)
(1)
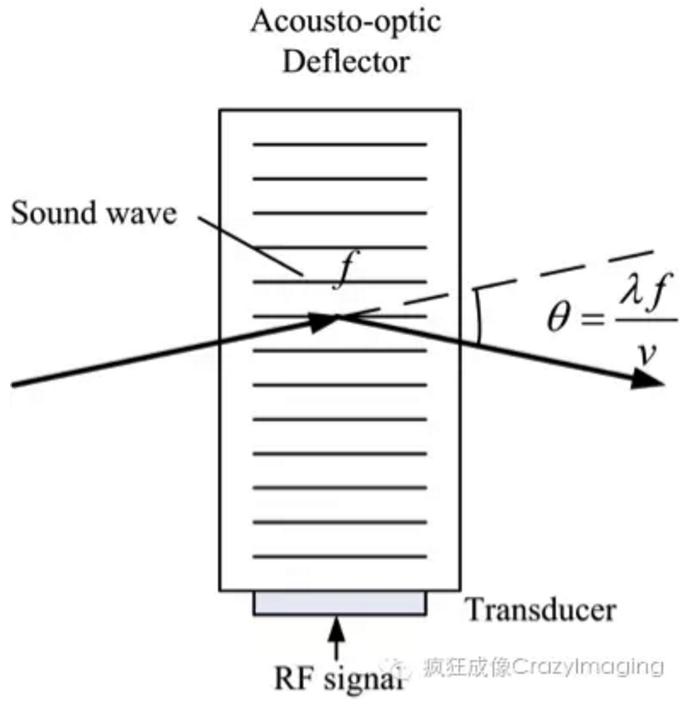
图1 声光偏转器(AOD)工作原理
AOD相对于机械式偏转器(如振镜、多面镜)的优点是无机械惯性,扫描速度快;机械振镜在机械转动时产生高频声音噪声,而AOD则没有;AOD长时间工作稳定性高,重复定位精度高[3]。
其中无机械惯性是AOD的主要优点。由于无机械惯性,AOD能实现“飞点扫描”,即两个分离的扫描点之间不需要经过中间其他点,两点扫描间隔时间在10微秒到30微秒之间[4],取决于声波在声光晶体中传播的渡越时间。目前能到达几十微秒量级的飞点扫描的器件只有AOD;电光扫描器原理上可以达到更快的速度,但目前还没有成熟的器件,可分辨点数只有几十。
AOD用在快速光栅扫描也很有优势,因为其回扫时间(约为渡越时间的一半)在微秒量级,最大行扫描时间可以达到10微秒~30微秒,因此其行频率可高达30~100kHz[5]。与之对比,检流计振镜的行扫描频率为1~2kHz,共振振镜的行扫描频率为8~12kHz,多面镜的行扫描频率为10~30kHz。
神经科学家们利用AOD快速扫描的特点,将之与双光子显微成像技术相结合,使得在活体动物内观察和记录快速的神经功能信号成为可能。
Chen等利用AOD的快速光栅扫描方式实现了1000Hz的双光子图像刷新频率,图像的二维像素数为250×80,并用这种快速双光子显微镜记录到了活体小鼠皮层树突棘的功能信号[6]。
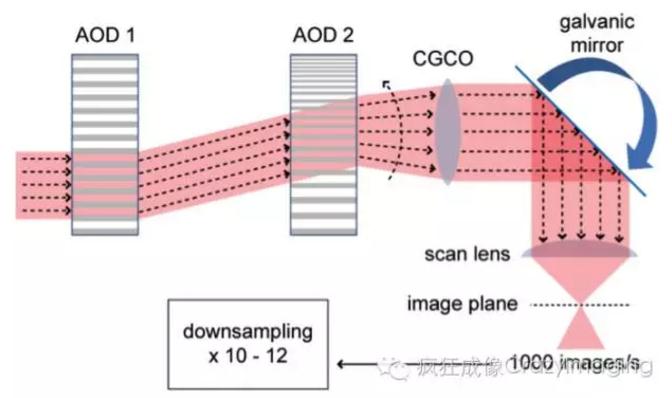
图2 AOD快速光栅扫描实现1000Hz双光子图像刷新频率(引自[6])
利用AOD的“飞点扫描”可以实现随机扫描(Random-acess),即只扫描感兴趣点或区域的信息。随机扫描不会经过两个感兴趣点之间的无用点,因此其扫描频率和在感兴趣点上的停留时间会大大提高,这种扫描策略在保持高的信噪比下极大地提高成像的时间分辨率。
2010年,BenJamin等利用随机扫描策略,在活体小鼠上获得了毫秒时间分辨率的二维分布的神经功能钙信号[4]。2012年,Gergely等通过四个AOD联合扫描的方式实现了在0.7mm ×0.7mm ×1.4mm体积范围内对数百个神经元细胞的随机扫描成像,时间分辨率在80Hz以上[7]。
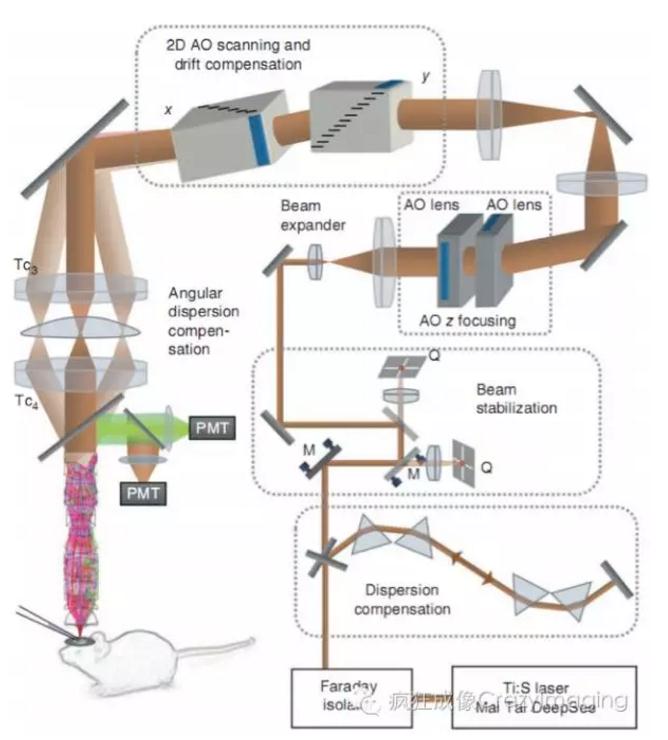
图3 利用AOD实现三维随机扫描(引自[7])
声光偏转器在双光子显微镜中得到应用离不开其色散问题的解决。由于双光子显微镜的光源“飞秒激光”是一种宽光谱光源,因此声波的衍射和声光晶体的材料色散会引起飞秒激光在空间和时间上产生畸变,最终会导致焦点处的双光子激发效率降低。曾绍群、李德荣等人总结了声光偏转器对飞秒激光的空间色散和时间色散的影响规律,并提出一种简易的单棱镜色散补偿方法[8]。
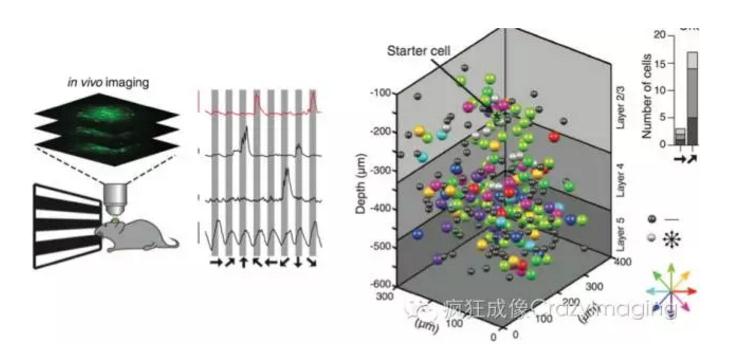
随着神经科学研究的深入,科学家越来越需要研究快速的多神经元细胞间的通讯[9],2015年瑞士巴塞尔Friedrich Miescher生物医学研究所RoskaBotond研究组利用AO技术展示了小鼠视觉皮层三维体系内数百个细胞同时(≤0.1秒)的钙信号反应,从而阐述出其功能关联性。将来随着新的高速、高信噪比荧光蛋白的不断出现,AO技术将在阐述功能性研究方面发挥更加重要的作用。
多细胞同步测量