您好,欢迎来到显微镜配件耗材官网!
 最新资讯返回
最新资讯返回
荧光寿命(fluorescence lifetime)是指荧光分子在激发态停留的平均时间: 当N个分子在同一时刻(t = 0)被激发,经过一定的时间它们最终会回到基态,通常伴随着光子的发射,其速率由荧光辐射去活(kr)和非辐射去活(knr)两个过程来决定–“dN/dt = N·(kr + knr)”;所以荧光衰减随时间的变化可以用自然指数函数来描述,例如“N(t) = N(0)·exp(-t/t)”,其中N(t)是t时刻还在激发态分子的数量;t是荧光寿命,指N(t)降到N(0)的1/e(36.8%)所需的时间。荧光寿命是荧光分子本身固有的特性,但在另一方面,它可受荧光分子所处的环境影响而改变,比如温度,酸碱度,离子浓度等的细微变化,以及与其它分子之间的相互作用。这些特点使得测量荧光寿命对很多生命科学研究有着不可替代的作用,尤其是针对活细胞和活体的研究【1,2】。本文通过几个实例对荧光寿命成像在细胞生物学定量研究中的应用做一个简要的介绍。
最早在光学显微镜下的荧光寿命测量可以追溯到1959年【3】。 生物领域里用的荧光标记的荧光寿命一般在纳秒级别,测量上需要很精密的仪器,二十年前这些还仅局限于比较先进的物理实验室里。由于近十五年里荧光技术和光电工业的飞速发展,简单易操作的(turn-key)荧光寿命成像系统已经商业化。从技术层面来讲,荧光寿命的测量可分为时域或频域技术,两者在本质上是相通的,只是傅里叶变化的两边【2】。本文中的例子涉及了两种技术:时间相关单光子计数方法(TCSPC,time corrected single photon counting)【4】和数字频域技术(FastFLIM)【5】。TCSPC是最常用的时域技术,通过用脉冲激光激发和测量发射光子相对于激发脉冲的时间,从而直接记录荧光衰减的柱状图,荧光寿命由对衰减曲线的分析而得出。FastFLIM是一个新颖、先进的频域技术,可以同时测不同倍频的相移和幅度调制,而且没有模拟电路中死亡时间的限制,从而大大提高了数据采集速度。这两种技术在激光扫描共聚焦显微成像系统都有着广泛的应用。
与荧光共振转移(FRET)方法相结合,荧光寿命成像(FLIM)对细胞信号传导及调控,蛋白间的相互作用等生物研究发挥着很大作用【2,6】。荧光共振转移是指一个在激发态的分子(donor)通过非辐射、极向间的互动形式把能量转移给附近的另外一个分子(acceptor),这个过程需要三个必要条件:donor的发射谱和acceptor的吸收谱要有很好的重叠;donor的发射偶极和acceptor的吸收偶极要在一个方向上;donor和acceptor距离要很近(一般要在10nm以内)。共振能量转移效率(E)对donor-acceptor距离(r)的变化很敏感:“E = Ro6/(Ro6 + r6)”,其中Ro常数被称为Förster distance,由donor和acceptor的一些光物理参数决定,一般为几个纳米【7,8】。FLIM使得FRET的测量变得相对简单,通过测donor的荧光寿命变化可直接计算出共振能量转移效率,“E = 1 -(tDA/tD)”【9】,其中tDA和tD分别是donor在有和没有acceptor时的荧光寿命,tDA从FRET样品(donor+acceptor)中测量,而tD一般从测量donor单独标记样品中得到。相比于稳态荧光强度的 FRET 测量方法,FLIM-FRET有几点优势:
1. 不需要考虑跳色的影响,从而免去了计算和去除跳色杂质信号的麻烦;去除跳色杂质的准确性很大程度上依赖于信噪比、成像流程的设计和控制、以及跳色信号估算的算法,这些因素使得通过稳态光强度测量FRET的精确度在很多时候受到质疑。
2. 稳态光强度的FRET测量很容易受荧光标记光漂白或是激发光散射背景的影响, 而这些因素对FLIM-FRET的测量影响相对较低。例如,ALexaFluo700 荧光染色标记较容易被光漂白,但其荧光寿命在一定光漂白程度下并不受影响【图1】。
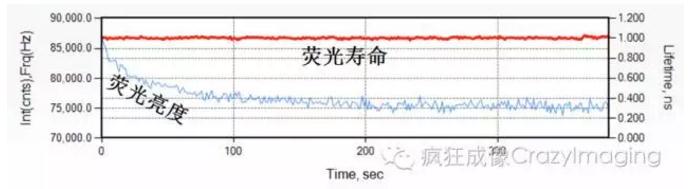
【图1】
3. FLIM-FRET可以定量的区分参与FRET和没有参与FRET的分子数量,这样深入的定量分析是稳态光强度方法做不到的。
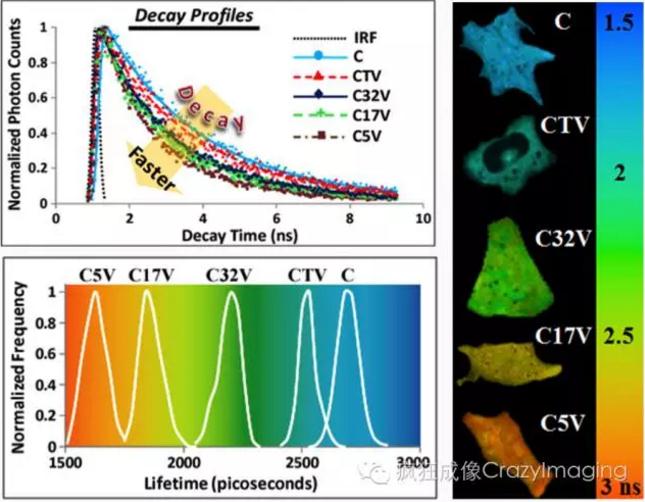
【图2】
【图2】给出了用FLIM在活细胞内测量荧光蛋白之间FRET的几个例子:C5V, C17V,C32V和CTV是美国NIH的Steve S.Vogel实验室发明的FRET-standard结构体,其中Cerulean(C,FRET donor)和Venus(V, FRET acceptor)荧光蛋白分别由5个、17个、32个氨基酸或TRAFdomain(229个氨基酸)连接【10】。C和V的距离越近,FRET越强,C的荧光寿命更短,所以通过测Cerulean的荧光寿命可以很容易区分这些结构体C-V间的细微的距离变化【6】。
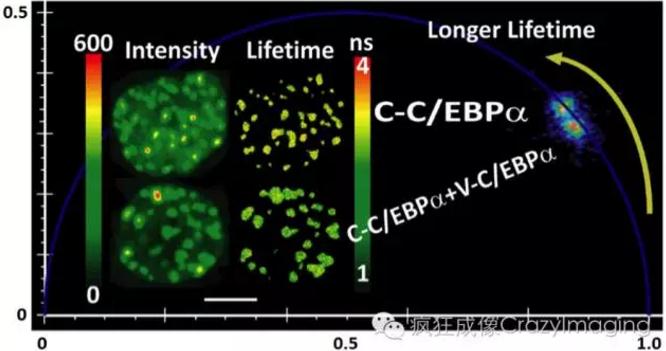
【图3】
【图3】描述了一个细胞生物学中的应用实例,通过FLIM-FRET来定位转录因子C/EBPa蛋白在细胞核里的二聚化【2】。Cerulean标记的C/EBPa和Venus标记的C/EBPa被同时表达于活细胞里,由Cerulean-C/EBPa和Venus-C/EBPa组成的双聚体使得Cerulean和Venus在FRET 距离内,从而通过FLIM测量Cerulean荧光寿命的变短可以证实CEBPa在细胞里的二聚化,而且通过观察细胞里的Cerulean荧光寿命分布图、以及共振能量转移效率分布图来定位C/EBPa的双聚化。
要得到荧光寿命的信息从而关联到生物学上意义需要对FLIM测量的原始数据进行分析。无论是对时域还是频域数据的分析,最常用的是传统的非线性最小二乘法拟合分析法。一般由用户来指定一个衰减模型(一个、两个或更多衰减指数)来对测量数据进行拟合。这个分析方法可以直接给出荧光寿命的数值,但需要用户对相关的物理数学模型以及拟合运算中统计理论依据有一定的理解,这对很多生物研究者来说可能是个挑战,尽管商业软件己经把这个拟合分析过程做的非常简化而容易操作。另一方面,相量图方法(phasor plots,也被称为polar plots或AB plots)【11-13】提供了更为直接、快速、简单明了的FLIM数据分析模式。这种方法最早被用在频域数据分析中,因为相量图就是由频域中测量的相位(f)和幅度调制(m)直接画出来的:横轴为m·cos(f);纵轴为m·sin(f)。所以相量图是原始测量数据的直接表达。值得一提是相量图法同样适用于时域数据的分析,只需要对时域数据进行傅立叶变化。相对于拟合分析,相量图分析法有几点优势【14】:
1. Model free:不需要任何分析模型,不需要用户有任何相关专业知识背景。
2. Unbiased:直接从测量的原始数据读取荧光寿命信息,避免了主观上的偏差。
3. Obvious:可直接读取个单衰减指数的荧光寿命,能很明显的区分单衰减/多衰减指数的不同物种,进行定性的比较,并有可能对多衰减指数物种进行定量解析【图4】。
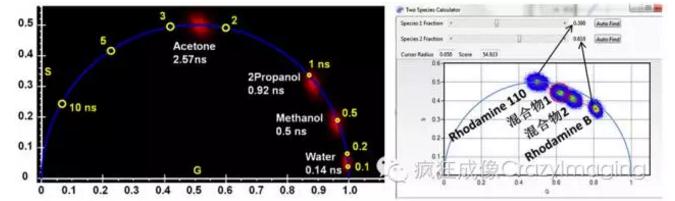
【图4】
【图4】在相量图上,有一条半圆线轨道,每一点对应一个单衰减指数的荧光寿命,(1,0)荧光寿命为零,(0,0)荧光寿命为无限,沿半圆线的反时针方向荧光寿命从小到大变化,单衰减指数物种在半圆线上,多单衰减指数物种在半圆线内;利用这些特性可以很容易分辩Rose Bengal在不同溶剂里的荧光寿命(左图,ISS Alba系统)。在相量图上,两种物种的混合物的位置一定在连接这两个物种分别位置的连线上,而且每个物种在混合物中占的比重可由混合物位置到每个物种位置的距离计算出来;利用这一特性可以很直接的在相量图上分解Rhodamine 110和Rhodamine B混合物(右图,ISS Q2系统),数据的分析用的是ISS 64位VistaVision软件
4. Interactive play:图像中的每个像点对应于相量图上的一点,在相量图上圈起一些有相似荧光寿命特征的一群点就可以看到其在图像中分布;反之,在图像中选择一个感兴趣的区域(ROI)也可以看到该区域像点在相量图上的分布。
5. Instant and large scale:由于不需要进行拟合运算,而仅仅在相量图上画原始数据,数据的分析速度是即时的,而且所有的实验图像可以在同一个相量图上进行比较分析【图5】。
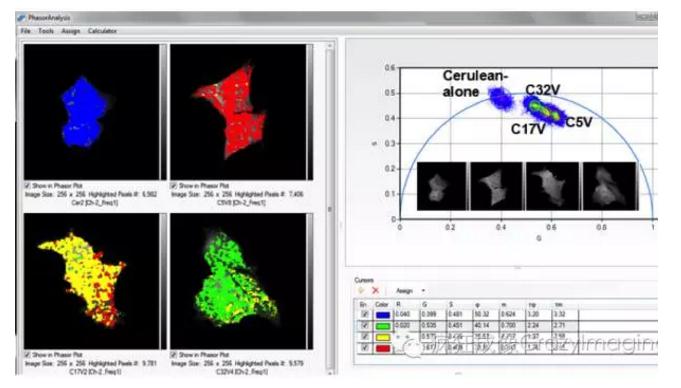
【图5】
【图5】用数字频域FLIM技术(FastFLIM)及相量图来区分不同的FRET-standard 结构体。
荧光寿命成像在其它的生命科学领域也有着广泛的应用。比如在癌症等一些医疗研究中对细胞内NAD(P)H 自发荧光的成像,NAD(P)H是细胞代谢活动的一个重要参考指示,FLIM己成为一个重要的工具去定量区别free/bound NADH,这有助于对细胞代谢在一些病变(比如癌症、糖尿病等)中的变化有更加深入的认知【15,16】。FLIM在技术层面已经非常成熟,而且也可以很容易的搭配到各种显微成像平台 - 宽场或单双光子共聚焦等等。随着生命科学对定量成像的需求更加深入,相信FLIM一定会有更加广泛的应用前景。
1. Periasamy, A. and R. M. Clegg .2009.FLIM microscopyin biology and medicine. CRC Press, London.
2. Sun, Y., R.N. Day and A. Periasamy 2011.Investigating protein-protein interactions in living cells using fluorescencelifetime imaging microscopy. Nat. Protoc. 6, 1324-1340.
3. Venetta, B. D. 1959. Microscope phase fluorometerfor determining the fluorescence lifetimes of fluorochromes. Review ofScientific Instruments. 30, 450-457.
4. Becker, W. 2005. Advanced Time-Correlated SinglePhoton Counting Techniques. Springer, Berlin.
5. Colyer, R. A., C. Lee and E. Gratton 2008. A novelfluorescence lifetime imaging system that optimizes photon efficiency. Microsc.Res. Tech. 71, 201-213.
6. Sun, Y., H. Wallrabe, S.A. Seo and A. Periasamy2011. FRET microscopy in 2010: The legacy of theodor forster on the 100thanniversary of his birth. Chemphyschem. 12, 462-474.
7. Förster, T.1965.Delocalized excitation andexcitation transfer; In InModern quantum chemistry, Sinanoglu, O., editors.Academic Press Inc., 93-137.
8. Clegg, R. M.1996.Fluorescence resonance energytransfer; In Fluorescence imaging spectroscopy and microscopy, Wang, X.F., Herman, B., editors. John Wiley & Sons Inc., New York. 179-251.
9. Lakowicz, J. R. 2006. Principles of fluorescencespectroscopy. Springer, New York.
10. Koushik, S. V., H. Chen, C. Thaler, H.L. Puhl 3rdand S.S. Vogel 2006. Cerulean, venus, and VenusY67C FRET reference standards.Biophys. J. 91, L99-L101.
11. Digman, M. A., V.R. Caiolfa, M. Zamai and E.Gratton 2008. The phasor approach to fluorescence lifetime imaging analysis.Biophys. J. 94, L14-6.
12. Redford, G. I. and R.M. Clegg 2005. Polar plotrepresentation for frequency-domain analysis of fluorescence lifetimes. J.Fluoresc. 15, 805-815.
13. Hanley, Q. S. and A.H. Clayton 2005. AB-plotassisted determination of fluorophore mixtures in a fluorescence lifetimemicroscope using spectra or quenchers. J. Microsc. 218, 62-67.
14. Skala, M. C., K.M. Riching, A. Gendron-Fitzpatrick,J. Eickhoff, K.W. Eliceiri, J.G. White and N. Ramanujam 2007. In vivomultiphoton microscopy of NADH and FAD redox states, fluorescence lifetimes,and cellular morphology in precancerous epithelia. Proc. Natl. Acad. Sci. U. S.A. 104, 19494-19499.
15. Thomas S. Blacker, Zoe F. Mann, Jonathan E. Gale,Mathias Ziegler, Angus J. Bain,Gyorgy Szabadkai, & Michael R. Duchen 2014.Separating NADH and NADPH fluorescence in live cells and tissues using FLIM。NATURE COMMUNICATIONS, 5:3936.