您好,欢迎来到显微镜配件耗材官网!
 最新资讯返回
最新资讯返回
光学显微成像技术在生命科学、材料科学和临床医学诊断等众多领域有着非常广泛的应用。早在16-17世纪,人们就已经发明了光学显微镜,并应用于观察软木塞的三维微结构,罗伯特•胡克因此首次发现并命名了“细胞”。与此同时,列文虎克使用光学显微镜首次观察到酒石上细菌的快速运动。随着科学技术水平的提升,光学显微镜的分辨率也逐步得到明显的提高。但是,在1873年,恩斯特•阿贝发现,由于受到光学衍射极限的限制,光学显微镜的空间分辨率存在一个理论上的极限;一般情况下,对于可见光,远场光学显微镜的横向分辨率只能达到250 nm左右。在此后的一个多世纪的时间,远场光学显微镜的分辨率均无法突破衍射极限的限制,因此,难以对纳米尺度的细胞结构,如蛋白、DNA、细胞器等进行更为深入的观察和研究,限制了光学显微在各个领域的应用。直到 20 世纪 80、90 年代,突破光学衍射极限的努力在理论上取得了重要进展。在1989年,W. E.Moerner和Kador在实验上成功地实现了对单个分子发射的荧光信号进行观测。之后,StefanHell和Mats Gustafsson分别在1992年和1995年提出了4pi和I5M的成像技术,使用两个相向放置的物镜进行成像,能够显著提升成像的轴向分辨率,达到100 nm左右。1994年,Stefan Hell等人提出一种基于受激辐射的方法实现突破衍射极限的远场光学成像技术;与此同时,在1995年,Eric Betzig提出一种基于单分子空间定位的方法实现超分辨率的光学成像。之后,在2000年,Stefan Hell在实验室首次实现了受激辐射光淬灭显微成像(STED),突破了衍射极限对于远场光学显微成像分辨率的限制,实现了远场光学超分辨成像。2006年,Eric Betzig、Samuel Hess和庄小威几乎同时在实验上实现了基于单分子空间定位的超分辨光学成像((f)PALM/STORM),也打破了光学衍射极限的限制。自此,远场光学超分辨成像技术得到了迅猛地发展,被广泛地应用到生命科学等各个领域的研究中去。超分辨成像技术的三位主要贡献者和奠基人 Eric Betzig、 Stefan Hell 和 W.E. Moerner 因此获得了 2014 年的诺贝尔化学奖。

图 1 (a)17世纪用于观察植物细胞的显微镜;(b)刻在恩斯特•阿贝墓碑上的光学衍射极限公式;(c)商业化的超分辨光学显微成像系统。
由于生物细胞是一个具有三维空间结构的生命单元,所以要实现对细胞的超精细结构进行全方位的观测,就需要发展三维超分辨成像技术。对传统的二维超分辨成像系统进行一系列技术改进之后,能够实现三维超分辨成像。在2008年,MatsGustafsson提出三维结构光照明显微成像(3D-SIM),使用光栅生成空间三维的结构照明条纹,因此,在空间三个维度均实现了2倍的分辨率提升。2009年,Thomas Dertinger等人提出基于荧光涨落的SOFI超分辨成像技术,同时也从理论和实验上证明了 SOFI 用于三维超分辨成像的可行性。3D SOFI可通过多种方式实现,可以在宽场显微平台上做z方向扫描完成3D SOFI成像,也可以采用多平面(Multiplane)的图像采集方式实现3D SOFI成像,或者可以基于转盘共聚焦(Spinning-diskconfocal)的显微平台做z方向扫描,也能够实现3D SOFI超分辨成像。STED通过对成像系统的改进,也能够实现三维超分辨成像。 2008年,基于4pi显微平台,Schmidt等人提出isoSTED(4pi-STED)实现了三维超分辨成像。2012年,3D RESOLFT实现以较低的光功率对神经元做三维超分辨成像。此外,3D-STORM通过引入柱面镜产生像散,使得不同深度的PSF截面具有不同的偏心率,从而完成三维空间的精确定位,实现三维超分辨成像。通过使用空间光调制器(Spatial Light Modulator, SLM),改变系统PSF的三维空间分布,也能够做三维超分辨成像。比如,Pavani等人提出双螺旋PSF的方法(DH-PSF),还有Shu Jia等人提出的自体弯曲PSF的方法(SB-PSF),均实现了三维的超分辨成像。此外,Juette等人提出基于双平面的FPALM成像,实现了三个空间维度均小于100 nm分辨率的超分辨成像。2013年,Yong Wang等人提出QDB3的方法,即基于量子点闪烁特性的三维超分辨成像方法,首先通过引入柱面镜产生像散,再通过相邻帧图像相减的方法有效降低每帧量子点被激发的密度,然后经过空间定位精确确定各个荧光分子的空间位置,类似3D-STORM的方法,z方向的位置可以通过 PSF 的偏心率计算出来,进而实现三维的超分辨成像。2014年,Chen等人提出的三维晶格光切片显微成像技术(Lattice light sheet),实现了深度的高时空分辨率成像。最近,Yu等人提出GB-STED,即使用高斯光束用于荧光激发,空心贝塞尔光束用于荧光淬灭,实现了大深度的超分辨成像,成像的深度突破了150 μm,分辨率小于100 nm。自此,各种三维超分辨成像技术的发展大力推动了生命科学的研究。我们根据三维成像的分辨率、成像深度和成像速度,对目前一些主流的三维超分辨成像技术进行分类,主要可以分成三个类型,包括:UH-3D-SR (超高分辨率三维超分辨成像)、UF-3D-SR (超快速三维超分辨成像)和UD-3D-SR (超深度三维超分辨成像)。UH-3D-SR技术能够实现很高的空间分辨率,但会在一定程度上牺牲成像的深度和速度;UF-3D-SR的分辨率虽然不及UH-3D-SR,但能够实现更快的成像速度,在用于对活细胞的研究中具有更大的优势;此外,UD-3D-SR的成像深度比较深,可以对细胞深部结构进行超分辨成像。
UH-3D-SR: Ultra-High resolution 3-DimensionalSuper-Resolution nanoscopy
UH-3D-SR技术能够实现超高空间分辨率的三维显微成像,主要包括4pi-STED、3D RESOLFT、DH-PSF、SB-PSF、3D STORM、QDB3、BP FPALM、DONALD等技术。在2008年,4pi-STED首次实现了三维STED超分辨成像。在4pi-STED中,xy平面的超分辨是通过在荧光淬灭光路中使用涡旋相位板来实现,而z方向的超分辨是采用两个相向放置的物镜同时进行荧光激发,STED光束经分束后分别进入两个对向放置的物镜,这时两束光在聚焦处互相干涉所形成的光场分布使得在z方向的光激发大小能够突破衍射极限,实现z方向的分辨率提升;而横向的分辨率提升则与传统的STED相同,采用0-2π的涡旋相位板生成环形光束实现。4pi-STED的三维空间分辨率均可以达到40-45 nm,成像视场为5×5×0.5 μm3。
3D RESOLFT是2012年由Testa等人提出的,使用较低的激光功率,用于对活体脑神经元进行超分辨成像。在实验中,通过在光路中使用两个不同的相位板调制三维的PSF分布实现三维超分辨成像。使用涡旋相位板生成环形淬灭光束,提升横向分辨率;使用角向相位板生成轴向的淬灭光束,提升轴向的分辨率。3D RESOLFT的成像横向分辨率可达90 nm,轴向分辨率为120 nm左右,由于采用逐点扫描的模式进行成像,所以成像的视场相对较小,为5.9×6.4×3.6 μm3。
传统的二维STORM基于单分子空间定位已经可以实现10-20 nm的空间分辨率。通过在光路中引入柱面镜产生像散,可以实现3D STORM超分辨成像。柱面镜的引入产生了像散,使得不同深度的PSF截面强度分布呈现出不同的椭圆偏心率,因此,只要事先准确测量出PSF偏心率与深度位置之间的关系曲线,荧光分子的深度位置信息可以通过PSF偏心率的大小计算出来。3D STORM在xy平面的定位精度可达10 nm左右,z方向的定位精度在20 nm左右。3D STORM超分辨成像的横向分辨率可以达到20-30 nm,轴向分辨率可达50-60 nm。
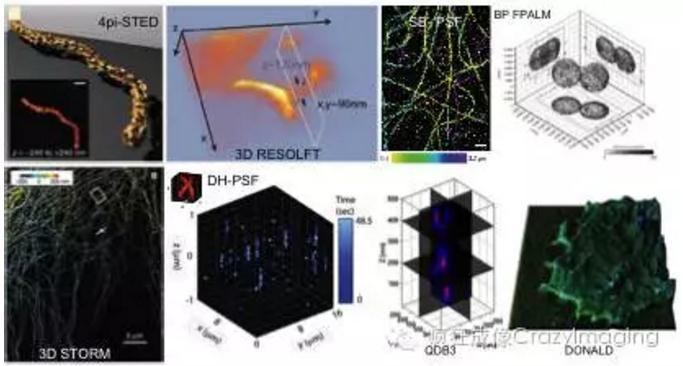
成像系统PSF的空间三维大小和分布决定了系统的三维空间分辨率。所以,三维超分辨还可以通过利用空间光调制器SLM对系统的三维点扩展函数PSF进行调制来实现。利用SLM可以将PSF调制成为双螺旋结构的空间分布(Double Helix PSF, DH-PSF),在这种情况下,三维PSF在不同轴向深度的二维截面强度分布具有不同的方向性。因此,通过分析DH-PSF在不同深度的方向分布,荧光分子的轴向位置也可以被精确定位出来,结合横向的单分子空间定位,最终可以获得三维的超分辨成像。基于DH-PSF的超分辨成像的定位精度可达10-20nm,成像视场为16×16×2 μm3。
除了DH-PSF,空间光调制器也可以将PSF调制成为自体弯曲的分布(Self Bending PSF, SB-PSF)实现三维超分辨成像。一般来说,艾里光束能够在不发生明显衍射的情况下进行长距离的传输,能够维持光束的强度分布,并且会呈现出横向自体弯曲的特性。因此,基于艾里光束,Shu Jia等人提出利用SB-PSF实现三维超分辨的方法。SB-PSF可以通过空间光调制器调制生成,不同荧光分子的深度信息可以由SB-PSF的不同横向偏移量计算出来。SB-PSF超分辨成像的三个维度的分辨率均可以达到50 nm左右,成像视场为5×5×3 μm3。
与PALM/STORM相似,FPALM通过单分子定位的方式可以实现二维的超分辨成像。在2008年,Juette等人通过使用双平面(Biplane)探测的方式实现了基于FPALM的三维超分辨成像BP FPALM。使用一个光束分束片将荧光采集光路分成两路,分别对应样品上的两个相距350nm的焦平面位置,然后在EMCCD上同时做成像。此时系统的三维PSF可以通过对荧光小球做z方向的扫描成像进行准确地测量。然后,将通过两个不同平面所采集的图像数据与系统的三维PSF进行拟合,就能够精确推算出所采集图像的深度位置信息,实现三维定位超分辨成像。经实验验证,BP FPALM成像的三维空间分辨率可以达到30×30×75 nm,成像视场为7×10×5 μm3。
与3D STORM相似,QDB3(基于量子点闪烁的三维超分辨成像)也是通过在光路中引入柱面镜的方式实现三维超分辨成像。不同的是,3D STORM是通过对荧光分子进行有序的开关调控,使在每帧图像中荧光分子处于单分子状态;而QDB3是依赖于荧光分子的随机荧光闪烁特性,并不要求荧光分子处于单分子状态。因此,QDB3允许采集时每帧图像拥有更高的分子密度,大大降低图像采集时间,提高成像的速度。然后,通过图像相邻帧之间的相减可以有效地降低单帧的分子密度,对相减后的图像帧进行单分子高精度定位成像。与3D STORM类似,荧光分子轴向的位置信息可以通过测量其PSF的偏心率获得,单量子点的实验结果显示,QDB3的横向分辨率可达8-17 nm,轴向分辨率为58 nm。在实际的生物实验中,使用量子点标记表皮生长因子受体EGFR,QDB3的方法能够分辨轴向相距100-150 nm的量子点分布。
全内反射荧光显微成像技术(Total internalreflection fluorescence, TIRF)在生命科学的研究中已经取得广泛的应用。TIRF成像是依赖于倏逝波的激发,能够非常有效地消除背景噪声对图像质量的影响。除此之外,在TIRF光的照明下,荧光发射可以分解成两个部分,内临界角荧光(Under-critical angle fluorescence, UAF)和超临界角荧光(Super-critical angle fluorescence, SAF),当荧光分子处于不同的深度时,所探测到的这两部分荧光的比例会有所不同,因此,根据不同的比例就可以精确确定深度信息,实现三维超分辨成像,这种方法称为DONALD (Direct Optical Nanoscopy with Axially Localized Detection)。UAF和SAF之间的比例与轴向距离具有很大的相关性,当荧光分子位于盖玻片上时,即轴向深度为0,则SAF所占的比例可达50%;而当荧光分子与盖玻片之间的距离大于一个波长时,UAF则占据大部分的荧光光强。因此,通过分析UAF和SAF两个分量的比例就可以精确地定位荧光分子的轴向深度距离。使用DONALD方法,可以实现三个空间维度20nm左右的定位精度,成像视场可达20×20×0.2 μm3。
参考文献:
[1] Pavani SRP, Thompson MA, Biteen JS,Lord SJ, Liu N, Twieg RJ, Piestun R, Moerner WE. 2009. Three-dimensional,single-molecule fluorescence imaging beyond the diffraction limit by using adouble-helix point spread function. Proc Natl Acad Sci 106:2995-2999.
[2] Bourg N, Mayet C, Dupuis G, Barroca T,Bon P, Lécart S, Fort E, Lévêque Fort S. 2015. Direct optical nanoscopy withaxially localized detection. Nat Photonics 9:587-593.
[3] Schmidt R, Wurm CA, Jakobs S,Engelhardt J, Egner A, Hell SW. 2008. Spherical nanosized focal spot unravelsthe interior of cells. Nat Methods 5:539-544.
[4] Jia S, Vaughan JC, Zhuang X. 2014.Isotropic three-dimensional super-resolution imaging with a self-bending pointspread function. Nat Photonics 8:302-306.
[5] Wang Y, Fruhwirth G, Cai E, Ng T,Selvin PR. 2013. 3D super-resolution imaging with blinking quantum dots. NanoLett 13:5233-5241.
[6] Huang B, Wang W, Bates M, Zhuang X.2008. Three-dimensional super-resolution imaging by stochastic opticalreconstruction microscopy. Science 319:810-813.
[7] Juette MF, Gould TJ, Lessard MD,Mlodzianoski MJ, Nagpure BS, Bennett BT, Hess ST, Bewersdorf J. 2008.Three-dimensional sub-100 nm resolution fluorescence microscopy of thicksamples. Nat Methods 5:527-529.
[8] Testa I, Urban NT, Jakobs S, EggelingC, Willig KI, Hell SW. 2012. Nanoscopy of living brain slices with low lightlevels. Neuron 75:992-1000.
[9] Gustafsson MG, Shao L, Carlton PM, WangC, Golubovskaya IN, Cande WZ, Agard DA, Sedat JW. 2008. Three-dimensional resolutiondoubling in wide-field fluorescence microscopy by structured illumination.Biophys J 94:4957-4970.
[10] Chen X, Zeng Z, Wang H, Xi P. 2015.Three-dimensional multimodal sub-diffraction imaging with spinning-diskconfocal microscopy using blinking/fluctuating probes. Nano Res 8:2251-2260.
[11] Geissbuehler S, Sharipov A, Godinat A,Bocchio NL, Sandoz PA, Huss A, Jensen NA, Jakobs S, Enderlein J, Van Der GootFG. 2014. Live-cell multiplane three-dimensional super-resolution opticalfluctuation imaging. Nat Commun 5:5830.
[12] Dertinger T, Xu J, Naini OF, Vogel R,Weiss S. 2012. SOFI-based 3D superresolution sectioning with a widefieldmicroscope. Opt Nanosc 1:1-5.
[13] Yu W, Ji Z, Dong D, Yang X, Xiao Y,Gong Q, Xi P, Shi K. 2016. Super-resolution deep imaging with hollow Besselbeam STED microscopy. Laser & Photonics Reviews 10:147-152.