您好,欢迎来到显微镜配件耗材官网!
 最新资讯返回
最新资讯返回葡萄糖是动物的主要能量来源。当面临重大威胁时,动物身体进入紧张状态,快速动员葡萄糖储存导致血糖水平升高。此过程被称为应激性高血糖(Stress-induced hyperglycemia),这是一种动物在应激状态时的基本适应性反应,为机体提供足够能量来应对威胁。然而,应激性高血糖也会造成脑、肝脏及心肌等组织损伤。此前,中枢神经调控应激性高血糖的发生机制一直并不清楚。
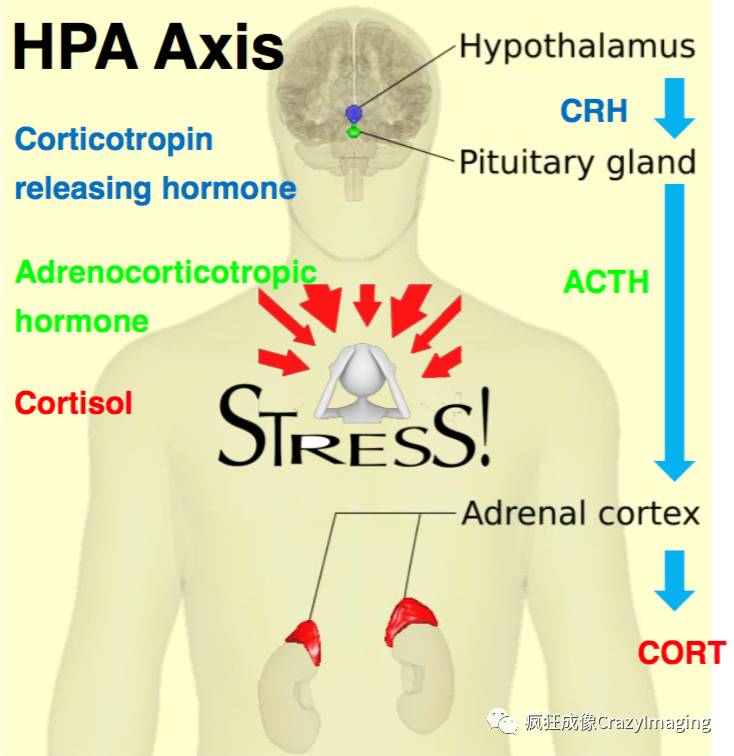
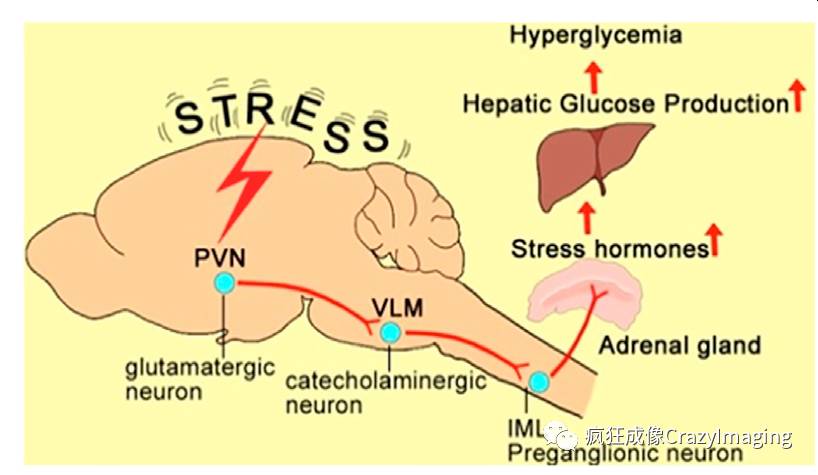
已知的主要参与调控应激反应的系统是下丘脑-垂体-肾上腺轴 (The hypothalamic-pituitary-adrenal axis, HPA axis) 和交感神经系统(Sympathetic nervous system)。当紧张刺激机体时,下丘脑旁壁核(Paraventricularnucleus of hypothalamus, PVN)分泌促肾上腺皮质激素释放激素(Coticotropin releasinghormone, CRH), 在垂体前叶(Anterior pituitary gland),CRH诱导促皮质激素细胞释放储存的促肾上腺皮质激素(Corticotropin, or Adrenocorticotropic hormone, ACTH)。ACTH通过血液到达肾上腺 (Adrenal gland) 的皮质区域,促进肾上腺迅速合成皮质激素,如:皮质醇(Cortisol)。皮质醇是一种主要的应激激素,可以作用于身体的多种组织器官,调控机体的紧张程度。此过程如图1所示。同时,应激反应也会兴奋交感神经系统(该系统的中枢部位于脊髓胸段全长及腰髓1~3节段的灰质侧角),进而兴奋心脏、肝脏以及肾上腺等外周器官。其中,交感神经节前神经元通过释放乙酰胆碱直接地兴奋肾上腺细胞,肾上腺髓质细胞分泌肾上腺素和去甲肾上腺素,进而刺激肝脏细胞,加快糖原分解反应而快速升高血糖(请参考图5)。因此,HPA 轴和交感神经系统同时参与应激反应,然而应激性高血糖可能主要由交感神经系统参与。
图1. HPA 轴
中枢神经系统中的后脑(Hindbrain)区域存在大量的交感神经系统前神经元(Presympatheticneuron),包括蓝斑核(Locus coeruleus, LC)和大脑腹外侧延髓(Ventral lateral medulla, VLM)的茶酚胺能神经元(Catecholaminergic neuron, CA neuron)等。这些神经元直接地支配交感神经系统。已有文献报道LC NTS和VLM的CA神经元参与调控血糖水平。综合以上线索,我们猜想后脑区域的CA神经元通过支配交感神经系统参与调控应激性高血糖的发生。
2017年6月15日,北京生命科学研究所(NIBS)占成组等在《Neuron》杂志在线发表了题为”A Central CatecholaminergicCircuit Controls Blood Glucose Levels during Stress”的文章。我们的此项研究证实了这一猜想,后脑 CA 神经元通过交感神经系统调控应激性高血糖,并且发现只有VLM CA神经元在此过程发挥核心作用。通过对其上下游环路研究,首次清楚地阐明了应激性高血糖的神经环路机制,即PVN - VLM - 脊髓(Spinal cord)-肾上腺(Adrenal gland)。
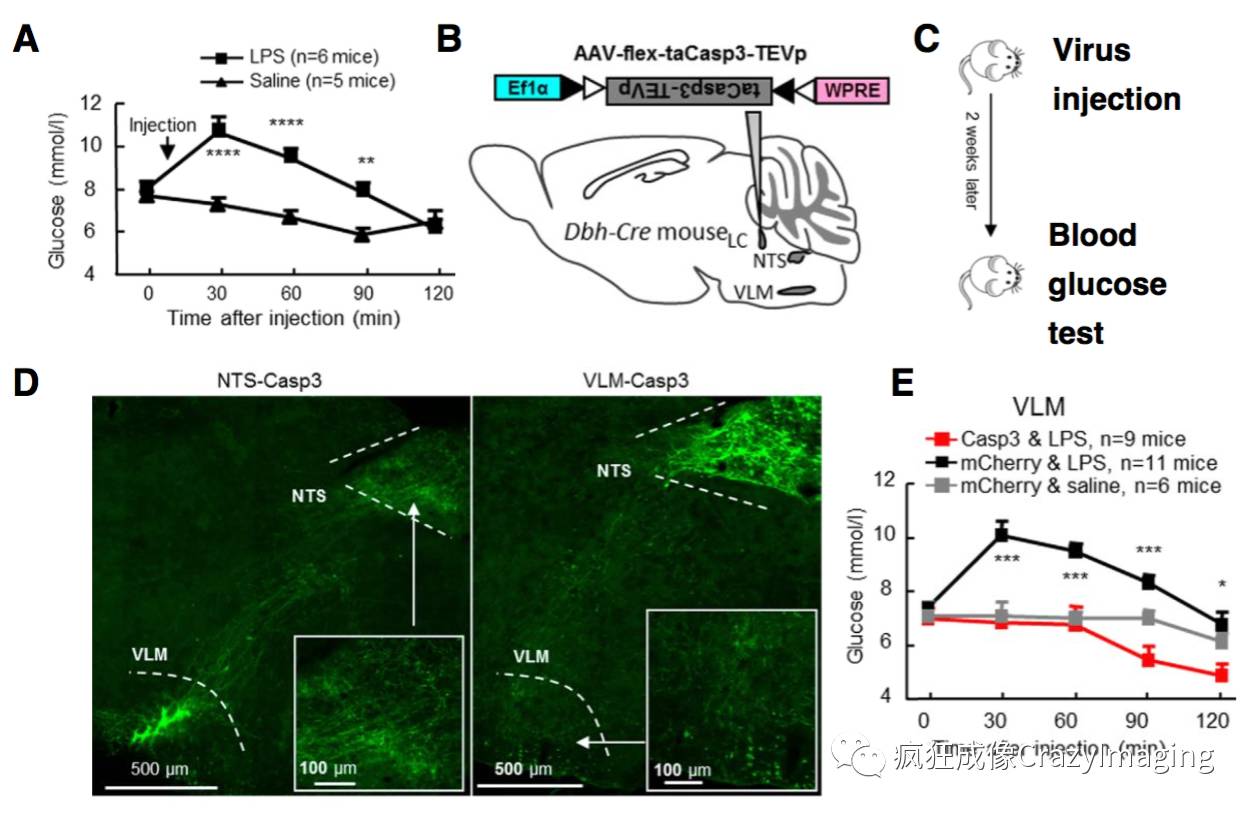
文章中,首先应用约束(Restraint),足底电击和注射脂多糖(Lipopolysaccharides)等方法诱导小鼠血糖升高,建立应激性高血糖模型(图2, A)。随后研究了LC,孤束核(Nucleus of solitary tract, NTS)和VLM等多个核团在应激性高血糖中的作用,发现特异的损毁VLM CA神经元可以阻止应激性高血糖的发生(图2, E)。利用显微立体定位注射技术将基于Cre重组酶表达Caspase-3的病毒载体送至Dbh-Cre转基因老鼠的特异脑区(图2, B),Caspase-3只在CA神经元中表达并激活,从而诱导细胞凋亡(图2, D)。
图2. VLM CA神经元在应激性高血糖中具有重要作用
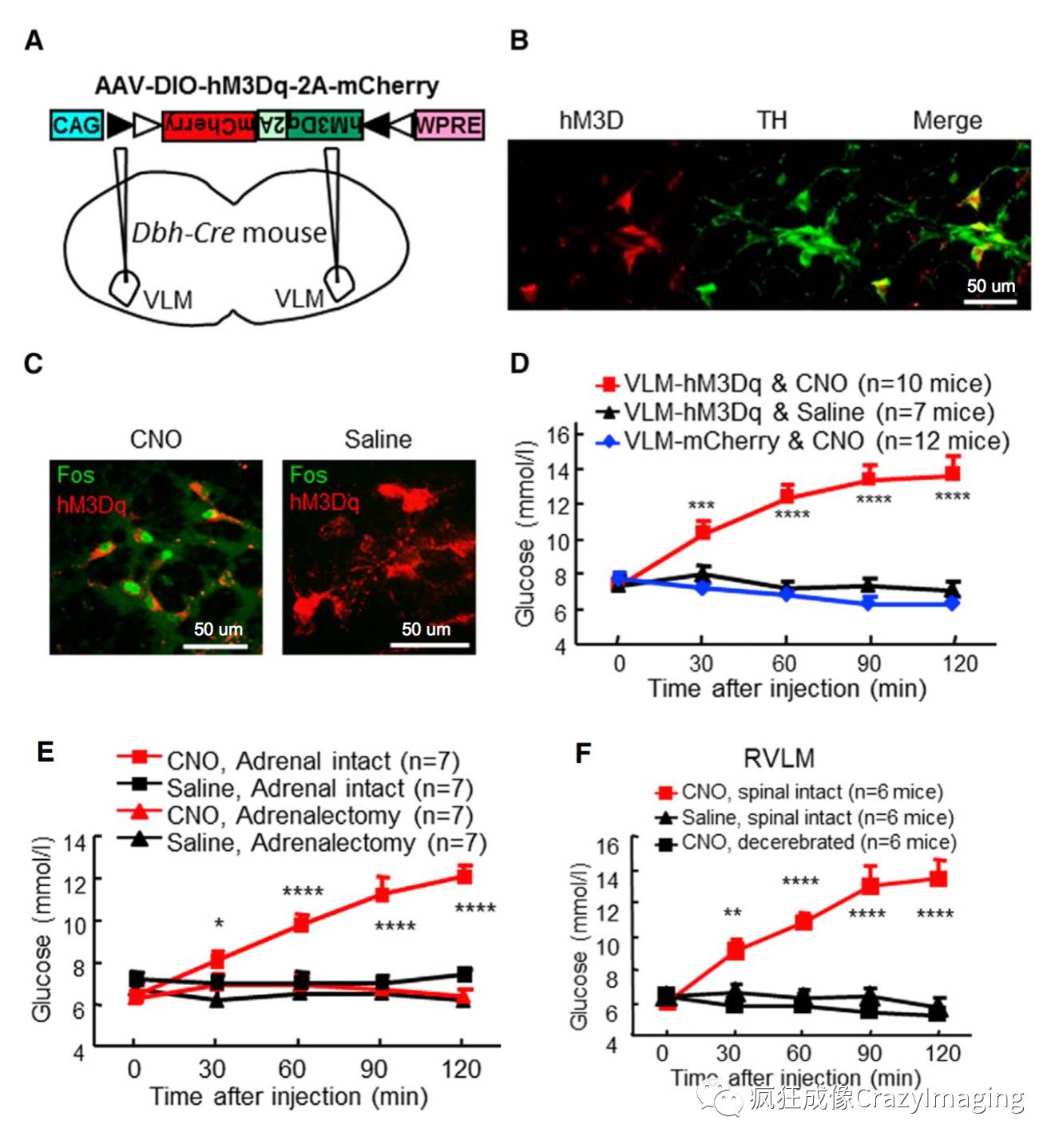
进一步的研究发现,特异的激活VLM CA神经元则快速增加血糖水平(图3, D),并通过投射到脊髓的下行通路(图3, E F),影响肾上腺激素的释放,促进肝糖原分解来提高血糖水平。利用化学遗传学(Chemogenetics)方法,在VLM CA神经元中特异的表达hM3Dq(Gq-DREADD, Designer ReceptorsExclusively Activated by Designer Drugs),Clozapine- N-oxide (CNO) 可以激活Gq-DREADD 及Gq细胞通路,提高神经元的活性(图3, C, Fos 的表达说明细胞活性提高)。
图3.VLMCA神经元通过投射到脊髓的下行通路快速提高血糖水平
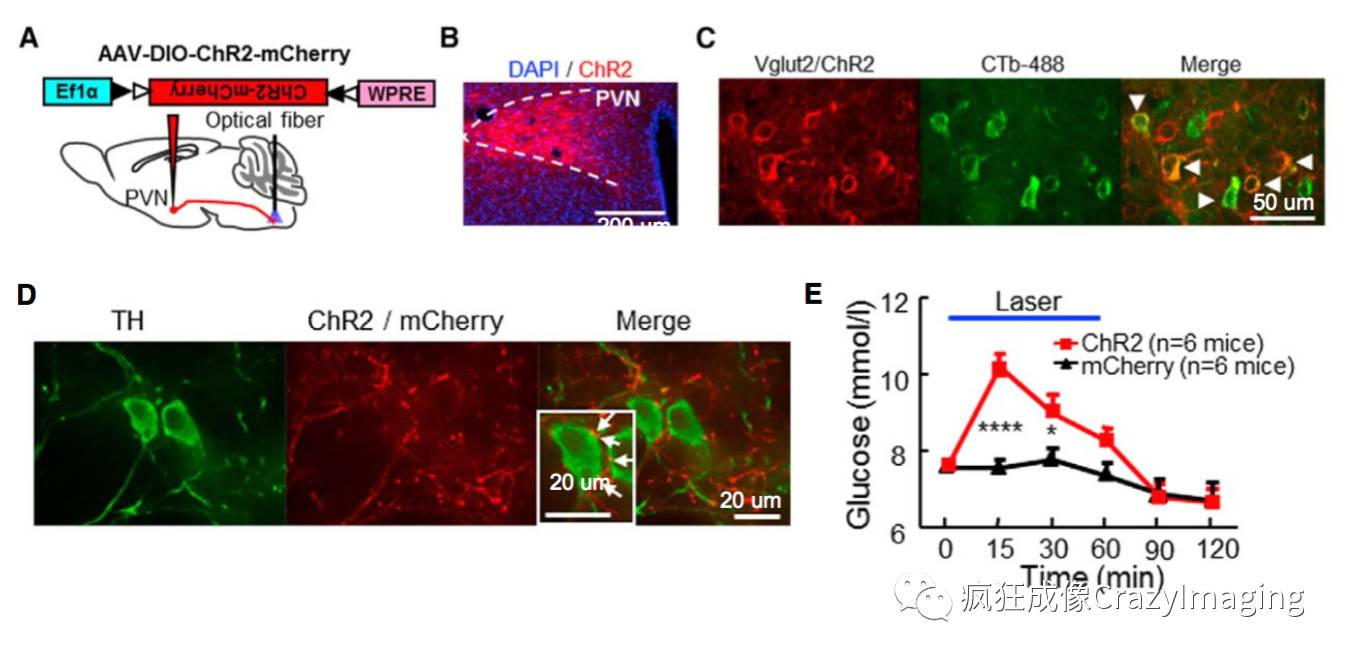
通过全脑逆向跨突触示踪还发现VLM CA神经元接受来自多个应激相关脑区的信号输入,如:下丘脑PVN,并发现其向VLM提供兴奋性输入而引发高血糖症状(图4, C E)。在这里,利用光遗传学(Optogenetics)方法,在PVN谷氨酸能神经元中表达ChR2(图4, A B),光刺激在VLM区域来自PVN的轴突末端(图4, A D), 特异激活PVN-VLM神经环路, 诱发高血糖(图4, E)。CTB-488是一种逆向示踪标记物,通过将CTB-488注射入VLM,同时在PVN谷氨酸能神经元中表达ChR2,观察到ChR2和 CTB-488共定位(图4, C),再次证明PVN谷氨酸能神经元直接地支配VLM神经元。
图4, A的光遗传学技术,首先在特异脑区注入ChR2病毒载体并埋上带有光纤的陶瓷插芯;在行为实验时,利用473 nm波长的激光器通过携带陶瓷插芯的光纤可与小鼠头上所埋的陶瓷插芯对接,并传入激光,实现对神经细胞的激活。
图4.下丘脑PVN向VLM提供兴奋性输入而引发高血糖症状
该文清楚地揭示了VLMCA神经元在应激性高血糖中的重要作用,以及调控血糖水平的PVN-VLM-Spinal cord-Adrenal gland 神经环路机制(图 5, IML, Intermediolateral nucleus, 脊髓的中间外侧核)。以往的研究多集中在静息血糖的调控中,对中枢神经系统如何调控应激性血糖相对较少,此项研究对于理解大脑如何控制能量代谢,尤其是在应激条件下的血糖调控有着重要贡献。另外,对于应激性高血糖症在临床治疗和药物开发上也有重要意义。
图5.调控应激性高血糖的神经环路示意图
主要参考文献:
Zhao et al., ACentral Catecholaminergic Circuit Controls Blood Glucose Levels during
Stress, Neuron(2017),95, 1–15 July 5, 2017