您好,欢迎来到显微镜配件耗材官网!
 最新资讯返回
最新资讯返回
运气比较好的是,在实验遇到困难时,我们偶然检索到了欧洲分子生物学实验室(EMBL)海德堡分所Jan Ellenberg为通讯作者的“Live imaging of cell division in preimplantation mouse embryos using inverted light-sheet microscopy”文章。这篇文章以实验手册的形式发表在“Methods in Cell Biology”上,里面描述了使用倒置光片显微镜做极早期胚胎发育成像的各种细节和注意事项。当然手册也不能包含作者的全部实验心得。我们在重复实验指导的过程中还是遇到了很多困难。我们后期还得到了EMBL的Lars Hufnagel教授及其EMBL实验室博士的亲自指导。他们的指导使我们了解到“每一个光子对细胞都是杀伤”的极致理念,也使我们更多地理解了环境控制对实验成功的重要性。
在多方面的指导和不断的试验尝试后,我们在国内的很多实验也都逐步取得了成功或正在通往成功的路上。感谢我们的用户不厌其烦的和我们一起反复实验并总结,探讨改进方案。下面和大家分享的文章基本上很忠实的翻译了原文,其中也加入了少量我们自己的实验心得,里面提到的很多实验理念不但适用于这里面提到的仪器,也适用于所有活细胞、活体实验,希望这篇文章能够帮助到更多相关实验者。由于一些用户数据还未发表,在这篇文章中我们还只是展示一些国外文章中的视频,不久以后我们会在这里为大家展示国内朋友获得的漂亮数据。
1简介系统的研究哺乳动物生命初始阶段细胞分裂过程是我们理解胚胎发育的基础。但是极早期和早期活体胚胎对光极度敏感,细致研究移植前胚胎细胞分裂具有极大的挑战性。使用宽场显微镜没有办法在三维空间内解析清晰的实验结果,由于图像模糊,即使在二维空间也很难取得理想的实验结果。用具备光学切片能力的共聚焦和转盘共聚焦显微镜可以获得清晰的三维胚胎图像,但他们都具有极高的光毒性和光漂白,只适用于解析某一时间点或极窄的时间段,不能持续的跟踪数小时到数天观察胚胎在三维空间内的持续变化。光片显微镜具备低照明、高灵敏度的特点,尤其在三维成像方面其使用的总照明强度可以仅为共聚焦的约千分之一(取决于样品厚度)。光片技术的出现为极早期胚胎成像创造了可能性。下面的实验步骤是在最近对小鼠胚胎成像有突破性进展的倒置光片显微镜上总结的。低曝光量、低光毒性和高成像速度是光片显微镜可以对早期胚胎进行高空间、高时间分辨率,并进行长时程三维成像的最大优势。这种成像方法可以让我们观察到受精卵到胚泡期的所有关键亚细胞结构,并对之进行定量分析。1.1 移植前胚胎发育成像哺乳动物生命始于受精,两个不分裂的单倍体细胞,卵母细胞和精子融合,导致二倍体合子(单细胞胚胎)的形成(Clift & Schuh,2013)。该单一全能细胞将经历一系列快速细胞分裂,以产生所有胎儿组织,同时支持胚外细胞谱系研究。因此,在哺乳动物生殖系减数分裂期间发生染色体分离,或在胚胎发生期间的早期有丝分裂分裂会给下一代带来严重后果(Mantikou,Wong,Repping & Mastenbroek,2012)。在过去,由于极早期和早期胚胎对光非常敏感,在不引起光致损伤的情况下,几乎不可能使用共聚焦或宽视场荧光显微镜对胚胎进行高采样频率或长时间成像,因此很难对生命开始时导致胚胎异常发育的细胞分裂进行全面分析。光片显微镜提供了低光毒性和高时空分辨率的解决方案,一束由照明物镜产生的光片从侧面照亮样品的一小部分。发射的荧光信号由另一个检测物镜收集,该物镜的光轴垂直于照明平面。光片显微镜的受光仅限于成像平面附近,因此与共聚焦或宽视野显微镜相比,光毒性、光漂白和离焦背景的不利影响极大降低。对样品极度温和的特性使光片显微镜成为活体胚胎成像的首选方法(Anonymous,2015)。除了减少光损伤外,培养环境是哺乳动物胚胎实时成像的另一个重要前提。在早期的光片显微镜应用中(Huisken,Swoger,Del Bene,Wittbrodt & Stelzer,2004),照明物镜和检测物镜水平放置,由琼脂糖包埋的样品竖直放置在物镜中心有限的空间内。这种设置与正常哺乳动物胚胎发育,尤其是植入前胚胎所需的培养条件不兼容。为了能够在生理条件下对活胚胎成像,Jan Ellenberg和Lars Hufnagel实验室设计并开发了一种倒置光片显微镜(Strnad等,2016),使用两个浸水物镜朝上,并且采用了新颖的样品安装方式,可以使用标准的微滴体外胚胎培养方法(standard microdrop in vitro embryo culture),还可以对许多胚胎并行成像(图1B)。本文的实验步骤设计专门针对小鼠胚胎进行了优化,但是此处介绍的倒置光片成像方法同样可以应用于多种生物样品,例如单个哺乳动物细胞或卵母细胞,大小相似的其他物种的胚胎以及最近比较热门的类器官模型。A

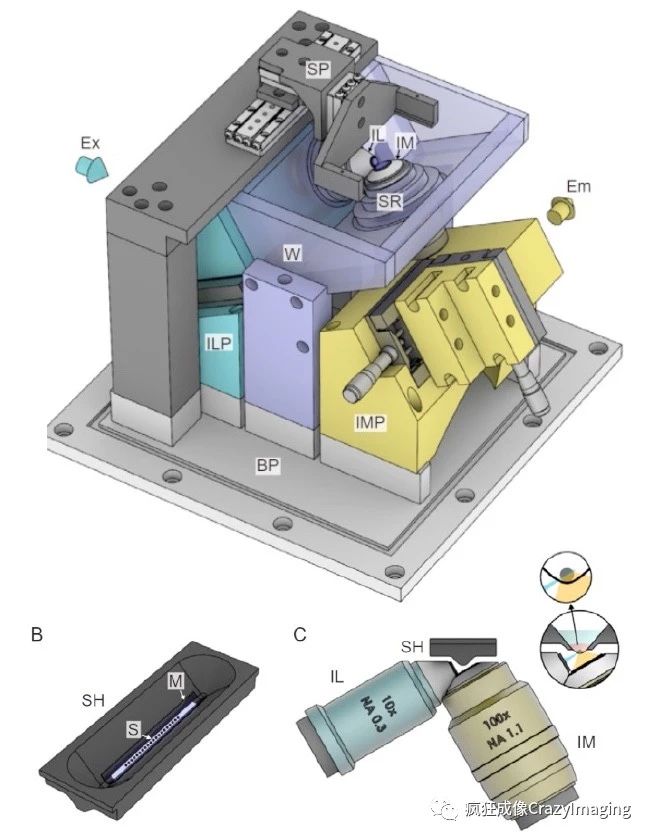
1.2 倒置光片显微镜简介
倒置光片显微镜的设计包含四个关键组件:一个照明物镜,在检测物镜的成像平面上形成一个光片;一个检测物镜,收集荧光信号并将其成像到照相机上;上样和定位模块;可提供受控的温度和气体环境的样品仓。
照明方法是光片显微镜与共聚焦或宽视野显微镜的主要差别。光片仅照亮样品的成像焦面,因为很少有离焦激发,所以具有良好的光学切片和出色的对比度。有两种实现光片照明的基本方法。一种使用柱面透镜将准直的激光束沿一个方向聚焦,同时在另外一个方向保持宽度和准直,从而形成静态光片。另一种方法不使用柱面透镜,而是使用扫描振镜在整个视场(FOV)中快速扫描聚焦的激光束并创建动态的虚拟光片。我们选择后一种扫描激光片的方法,因为它可以充分利用照明物镜的数值孔径,其照明更精细,图像信噪比更高,同时也为照明布置提供了更大的灵活性。
光片的厚度是需要考虑的重要参数,因为它不仅决定了光学切片的能力,而且还决定了光片的长度,进而确定了FOV的大小。可以通过调整照明激光的直径来调整光片的厚度。请注意,较薄的光片在中心提供更好的光学切片,但在FOV的边缘较差。因此,对于不同的应用,我们建议使用不同的光片厚度和长度做尝试,一般选择具有较窄的光束(如2μm)和较小的FOV(如30-50μm),另一种具有较厚的光束(3-5μm)和较大的FOV(≥120μm)。
在显微镜的检测单元中,两个最关键的设备部件是检测物镜和相机。对于检测目标,其数值孔径决定了可达到的衍射极限分辨率。放大倍率和相机传感器的尺寸一起确定了FOV;它的工作距离决定其焦平面的位置,从而决定样品的位置。
倒置光片显微镜有定制的样品架(图1B),可与微滴胚胎培养物兼容,并能同时成像许多胚胎。样品槽的设计尺寸约等同于带有凹痕的显微镜载玻片,在其中放置了一层生物兼容性较高的薄膜(FEP;Katco)以容纳培养基和胚胎。样品槽组件和样品安装的详细信息将在后面的专用部分中介绍。样品槽可通过配件适配器安装在三维载物台上(图1 SP,图2A),然后移动到两个物镜之间的水槽中(图1C,图2B)。使用FEP透明膜固定样品,样品完全与浸没介质物理隔离,并且可以保持在标准胚胎培养液中。FEP膜的折射率与水的折射率匹配,这避免了光学像差的主要来源。
整个样品处理部件都封闭在恒温样品仓中。样品仓可精确控制温度(37°C)和大气环境。微缺氧的环境会降低光毒性的影响,并有利于长期胚胎成像,而且不会干扰正常的胚胎发育,在自然的胚胎发育中,输卵管和子宫也是处于相对较低的氧气水平下。因此,可以使用气体混合器在培养箱内创建一个具有近似5%CO2、5%O2和90%N2的气体环境。

图2A InVi-SPIM样品槽以及样品仓

图2B 样品槽以及倒置光片成像示意图
2.1 制备样品槽
可以选择Luxendo提供的商品化样品槽制成品(¥$€),或者自己制作样品槽。两种样品槽使用的模具材料和薄膜材料都完全一致。
图3 自制样品槽工具(左)和商品化样品槽(右)制备过程中实验台必须清洁,操作人员必须带手套。首先要把透明的FEP薄膜剪成合适的尺寸来覆盖样品槽内侧。最好是事先设计好一个纸板或者塑料蒙版,覆盖在薄膜上沿纸板边缘裁切(图4A,步骤1)。把剪好的薄膜放在表面水平的无尘培养皿中备用。接下来使用无生物毒性的硅胶把薄膜粘到样品槽上。可事先准备使用注射器准备几份10ml左右的硅胶,将注射器密封并在4摄氏度保存,以避免在空气中曝光,可随时使用请按以下步骤制作样品槽(图4A)。 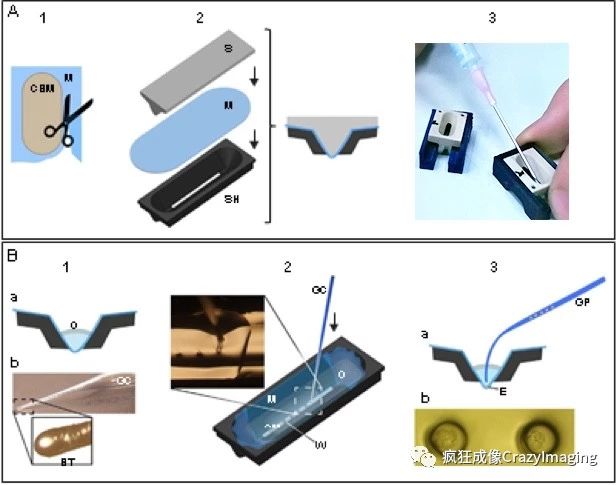
使用Luxendo InVi-SPIM给植入前的小鼠胚胎成像所需的样品槽以及样品固定步骤描述如下。(A) 1. 使用纸板蒙版(CBM)将薄膜(M)剪成合适的尺寸。2. 将少量硅胶(SG)沿样品槽顶部边缘均匀涂抹, 然后将剪好的薄膜覆盖在样品槽上, 使用压模工具将薄膜压入样品槽, 并使用橡皮筋固定。(B) 1. (a) 等胶凝固之后,将橡皮筋以及压膜工具取出,清洁粘好的薄膜,将培养基(CM)注入槽内,并用油(O)覆盖表面。(b) 将玻璃毛细管/移液管(GC)管头切成两半并使用本生灯加热使其融化成钝头(BT)。2. 将融好的钝头(GC)伸入覆盖有培养基(CM)和油(O)的样品槽底,在膜(M)上压出凹坑(W)。3. 使用口吸式移液管配合玻璃毛细管(GP)将单颗的小鼠胚胎(E)放入压好的凹坑。(b) 凹坑直径大概是胚胎的1.5倍,这样在载物台移动以及成像过程中能保持样品位置。
在真空环境中使用离子枪清洁薄膜两侧,移除所有的有机物,并增加附着力。任何使用紫外光在空气中生成氧自由基的设备都可以。清洁的时间长短取决于使用的设备并且需要根据经验调整。在处理之后,除了使用清洁并消毒过的设备触碰边缘之外,不要再触碰薄膜。
2使用70%乙醇清洁样品槽以及压膜工具,使用压缩空气移除灰尘。
3使用1ml注射器,在其中注入500ml硅胶,将硅胶推至注射器口。
4将22Gauge的针头切断,移除尖端,再小心的使用小钳子将针头开口打开(这一步也可以直接使用平头的上样针头,这样比较容易操作)。
5将针头连接注射器, 小心的沿样品槽顶部边缘之字形移动挤出少量硅胶, 切记不可过量, 因为硅胶太多会附着在薄膜上被挤压出底部, 并影响光路。
6将离子枪处理后的薄膜浸入干净烧杯中的500ml纯水清洁,然后将湿的薄膜平铺在镜头清洁纸上移除水分, 最后将干燥的薄膜放置在样品槽模具顶部。
7使用压模工具从中心将薄膜压入样品槽模具(图4A,步骤2)。从底部观察,薄膜必须平整的凸出样品槽底部,并没有硅胶附着。
8使用橡皮筋从两侧固定样品槽、膜以及压膜工具,避免橡皮筋碰触薄膜。
9将固定好的整个样品槽倒置在实验台上,凸出凹槽的薄膜面对自己。
10注射器中剩余的硅胶可用封口膜密封并在4摄氏度保存。
11将整个样品槽倒置放在干净的培养皿中过夜保存,使硅胶凝结并干燥。
石蜡油,G-1™ PLUS培养基都必须至少在成像前6小时保存在37摄氏度,5%二氧化碳,5%氧气的环境中。
2取下橡皮筋,拿出压膜工具,检查薄膜是否完整覆盖样品槽底部开口,检查薄膜跟样品槽之间是否有缝隙。
3使用压缩空气清除样品槽表面灰尘。
4移除平衡过的培养基表面油层,并使用移液管将其转移到样品槽中,过程中避免移液枪碰触薄膜。
5使用平衡过的石蜡油覆盖培养基表面。
6使用本生灯将100ml的玻璃移液枪头/毛细管加热并拉成两段。将细端端口加热,使之变成150-200mm直径的玻璃球钝口。等其冷却使用。
7将样品槽放置在体视显微镜下观察样品槽开口区域。使用做好的毛细管钝口沿薄膜底部压制凹坑(图4B,步骤2)。控制压制的力道,不要戳穿薄膜。凹坑应该沿样品槽开口中央以间距100mm左右直线排列。制好的毛细管钝口可以重复使用。谨记要在放入培养基以及石蜡油之后再压坑,否则在凹坑部位会出现气泡。
8使用口吸式移液枪将小鼠胚胎转移到凹坑中。每个凹坑放一个胚胎(图4B,步骤3b)。凹坑直径最好在胚胎直径的1.5倍左右,这样可以避免胚胎分裂过程中的外力干扰,并可以最大程度防止样品在转移以及成像过程中移动。