您好,欢迎来到显微镜配件耗材官网!
 最新资讯返回
最新资讯返回倒置光片显微镜使得活体观察早期哺乳动物胚胎成为可能。我们使用的是表达荧光标记的植入前小鼠胚胎。针对亚细胞结构的活细胞成像,可以参考Kline 2009,Abe,Aizawa & Fujimori,2013,Abe & Fujimori,2013,Johnson,2014等。针对类器官成像可以参考Alladin A,2019等文献。不管如何准备样品,重要的是最大程度的减少光杀伤,这样才能在长时高频的成像过程中不伤害细胞。对于小鼠胚胎成像的详细流程见下:
1.1. 显微镜设置
1在显微镜样品舱注入500mL脱气的蒸馏水,这样可以减少实验期间在FEP薄膜底部形成的气泡。一个类型的应用是追踪小鼠胚胎在细胞分裂过程中亚细胞级别的细胞器(400-500nm大小)。想要在图像分析过程中准确的分割这么小的结构就需要非常高的信噪比以及Z轴分辨率,这两个参数都跟光片厚度密切相关。光片(光腰)越薄,信噪比和Z轴分辨率就越高。但是降低光片厚度会大大增加高斯光的扩散程度,所以成像感兴趣区必须精确定义在光腰位置(图4A),并且视野不能定义的太大(我们使用的是30mm),来达到最优分辨率。这个示例应用主要是为了追踪着丝点以了解染色体移动,但是这个方法可以拿来研究所有的细胞系动态变化。为了更好的观察着丝点和DNA,我们分别用荧光标记了CenpC和H2B,参考图5B。
另外一种应用是通过标记细胞膜和DNA来观察早期胚胎发育过程中所有细胞的谱系,这类应用需要对胚胎中每个细胞以及它的后代做长达几天的追踪(图5C)。此类应用要求极低的光毒性,在重新植入前不对胚胎发育造成影响。我们用带MyrPalm-tdiRFP670的荧光蛋白观察细胞膜以及H2B荧光标记DNA。此类应用需要在一个较大的视野内均匀成像。所以成像过程中使用了较厚的光片,我们使用3mm光腰厚度,视野大约120mm,来观察整个小鼠胚胎(图5A)。信噪比和z轴分辨率比起2mm的光片厚度要差,但是足够用来分辨比如细胞膜和细胞核等较大的结构。
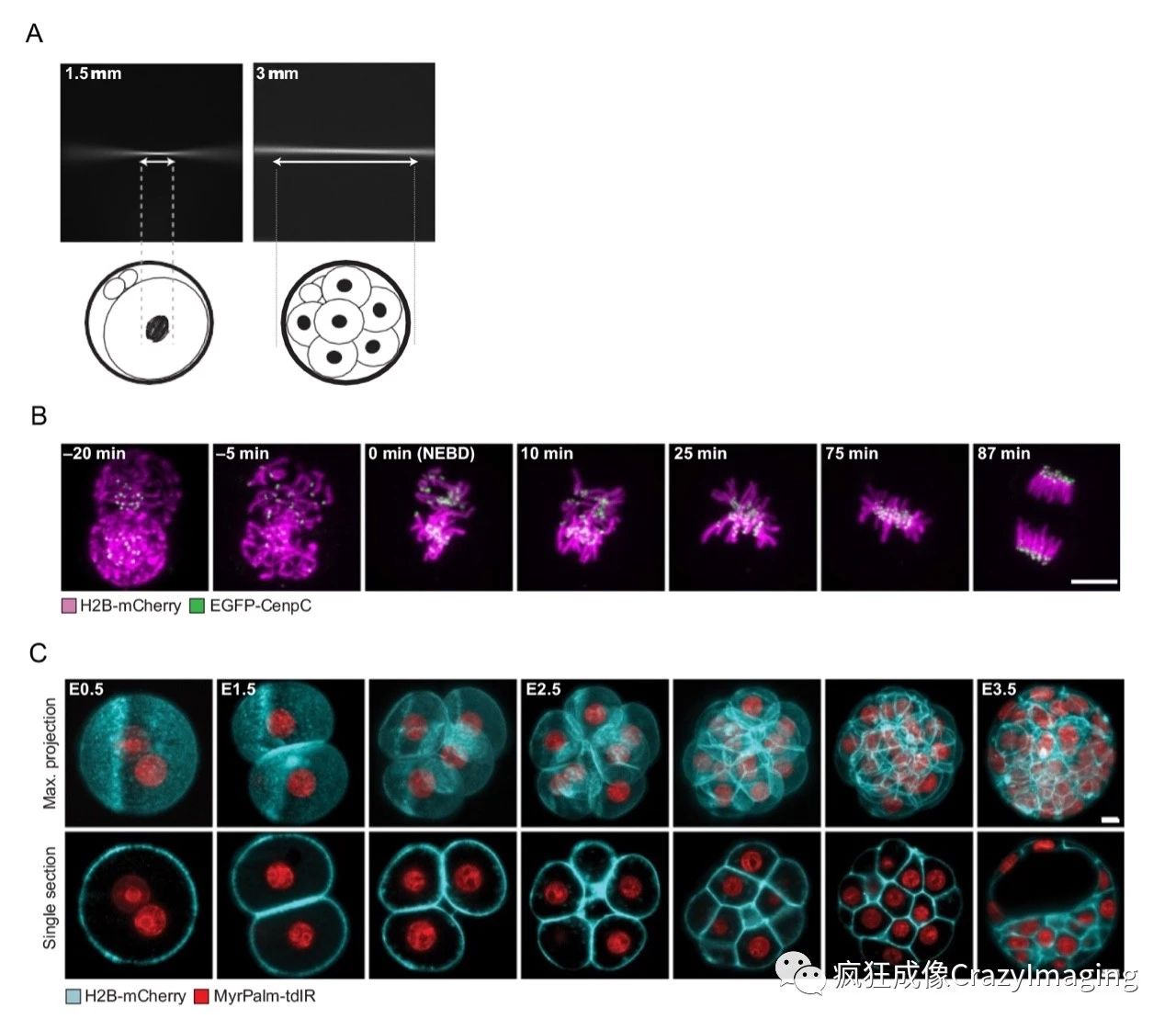
(点击图片可放大查看)
图5 使用InVi-SPIM进行活体成像。(A) 1.5mm和3mm光腰厚度的光片。1.5mm的焦面视野大概是20mm,3mm厚度的视野大于80mm(如白色箭头所示)。下面的胚胎图展示了如何在两种实验中达到对要观察结构最优的分辨率。(B) 线粒体(H2B-mCherry,洋红色)和着丝点(EGFP-Cenpc,绿色)的图片,Z轴间距520nm,时间分辨率30秒。(C) 染色体(H2B-mCherry,红色)和细胞膜(MyrPalm-tdiRFP670,青色)的图片,Z轴间距1040nm,时间分辨率5分钟。图片展示了胚胎发育的不同阶段。
6光片校准和调整是达到最优图片质量的关键。InVi-SPIM在校准之后是非常稳定的,但是依然建议在每次实验前都检查光片质量以及对焦,确认光片光腰最细,并且在视野内分布尽量均匀。
3.2 成像参数
为了尽量减少对胚胎的光杀伤,用户需要针对自己的实验需求调整最优的参数,不要尝试对样品进行超出实验需求的光照,信噪比、时间/空间分辨率、成像时长能满足实验即可。下面是一些建议的指导原则。
激光能量:对于活体小鼠胚胎,小于488nm的激光一般是不推荐使用的,虽然在很多情况下无法避免。在条件允许的情况下尽量使用靠近红色/红外波段的激光,尤其是需要拍多色时。拍照时激光必须设定在能观察到感兴趣组织的最低能量值以减少光杀伤和光毒性。激光强度和曝光时间是两个必须要仔细考虑的参数。一般情况下,建议在物镜后焦面的488nm的激光能量为0.05-4mW,561nm为0.05-5mW,642nm为0.25-20mW。
曝光时间:较短的曝光时间能减少样品移动产生的动态模糊,并增加时间分辨率。但是也需要较高的激光能量来达到相同的信噪比。一个细胞能承受的总曝光和单个曝光时间的关系不是线性的,但是一般来说,细胞在受到较短的脉冲光照射时看起来更健康些。在实验中我们使用的曝光时间是100ms,测试结果显示小鼠胚胎在这个设置中没有问题。
Z轴间隔:更多的z轴切面可以实现更高的轴向分辨率,但是样品受到的总曝光量也会增加。我们实验中对于较小的细胞器,比如着丝点,使用的z-轴步距是520nm(1.5mm光腰厚度的3倍取样),对于较大的结构,比如细胞核,我们使用1040nm的步距(也就是3mm光腰厚度的3倍取样)。选择的z轴切片的数量必须能够覆盖整个需要观察的区域并允许长时实验中些许的样品漂移,但是不能超出太多(>1.5x)。
时间间隔:减少时间间隔会增加样品接受的总曝光量。对于小于1分钟的时间分辨率,建议总实验时长应小于5小时。对于几天的长时实验,时间间隔应设置为5分钟或更久。
成像的胚胎数量:InVi-SPIM支持同时对多个胚胎成像。如果使用100ms的曝光时间,那么成像速度就是大约8.5帧每秒。考虑到载物台在不同胚胎之间移动的时间,我们使用8帧每秒进行计算。计算方法如下:如果每个胚胎拍100张z轴切片,那么每个胚胎拍照需要的时间就是12.5秒(100/8)。所以,如果要达到30秒的时间分辨率,我们只能在一个实验中最多拍两个胚胎(30/12.5)。如果是5分钟的分辨率,我们就可以最多拍24个胚胎(300/12.5)。可以通过调整曝光时间和z轴切片数调整胚胎数量。当然我们不建议经常使用显微镜的曝光和数据传输极限来做实验,建议给仪器留够足够的数据稳定读取和存储时间。
着丝点追踪的成像条件:我们使用90张的z轴切片,每30秒拍一次,488nm的激光能量是4.35mW,561nm激光能量2.5mW,曝光时间100ms。当核膜破裂的时候手动开始实验,染色体分离完成后结束实验。
核追踪实验的成像条件:130张z轴切片,每5分钟拍一次。561nm激光能量7.5mW,642nm激光能量13.47mW,100ms曝光时间。在前核期手动开始实验,3天后胚泡形成结束实验。
检测光杀伤:为了检测实验的光杀伤,胚胎在实验结束后可以转移回母体观察出生的健康小鼠数量,并和没有成像的对照组进行比较。光杀伤严重时,胚胎会停止分裂,或者在植入前阶段分裂严重延迟。轻微的光杀伤可以通过对比形成的微核数量来检测。实验参数需要被调整至实验组和未成像的对照组没有明显可见差异。
4.1 样品适配器组件
- 纸板模具
- FEP膜,50μm,Katco
- 硅酮胶,Silpuran 4200,Wacker
- 铝管,50g,圆柱形,pompldirekt,818104
- 离子清洁/激活仪器,例如Plasma Prep2,Gala Instrumente
- 压缩空气,例如Aerodoster 100,Servisol
- 70%乙醇
- 超纯水
- 样品槽, 压模工具
- 橡皮筋
- 22G针,例如Microlance™3,BD,300900
- 1mL注射器,例如Plastipak™,BD,300013
- 封口膜
4.2 上样
- 压缩空气,例如Aerodoster 100,Servisol
- G-1™PLUS培养基,Vitrolife,10128
- 用于胚胎培养的石蜡油,OVOIL™,Vitrolife,10029
- 玻璃毛细管,100μL,Blaubrand intraMark,708744
4.3 显微镜设置
- 脱气,双蒸水
- 气体混合和浓度控制装置
- 控温装置
此处介绍的成像方法比较易于使用,该方法主要用于对哺乳动物植入前胚胎发育过程进行实时成像,并可以并行地对数个胚胎同时进行记录。所需的光片显微镜用户可以根据先前描述的设置自行构建(Strnad等,2016),也可以直接购买成熟的商品化产品(品牌:Luxendo,中国独家代理:Tim Winter公司)。该方法能够提供足够的分辨率,以对植入前发育过程中发生的动态过程进行定量分析。例如,该系统使我们能够分析纺锤体的形成,并测量微管成核稳定性的潜在缺陷,以及纺锤体装配体的自组织,或者测定胚胎细胞如何适应第一分裂的规模和细胞结构变化。这为在植入前胚胎的4D数码库中绘制细胞分裂关键调控分子和细胞命运规则上开辟了令人振奋的新视角,并帮助研究人员更好的在分子层面上对哺乳动物早期发育进行理解。总之,当需要以高空间和时间分辨率和/或长时(例如几天)对哺乳动物胚胎或其他对光损伤敏感的标本成像时,这种基于光片显微镜的方法被证明是非常有效的。