您好,欢迎来到显微镜配件耗材官网!
 最新资讯返回
最新资讯返回酪氨酸磷酸化修饰是关键的蛋白翻译后修饰方式之一,在细胞信号转导通路中发挥了重要作用,其异常调控与多种严重的疾病息息相关,如肿瘤。磷酸化修饰方式在人体内负责添加磷酸基团的蛋白酪氨酸激酶(Protein Tyrosine Kinases, PTKs)和负责催化磷酸基团离去的蛋白酪氨酸磷酸酶(Protein Tyrosine Phosphatases, PTPs)可逆调控。由于PTKs的研究技术手段较为成熟,研究者们广泛揭示了PTKs在相关疾病发生中的作用机制,并在此基础上进行了系列药物的研发,目前,已经有20多种PTKs相关药物在临床上应用。PTPs也是很多疾病治疗及药物开发的靶点,然而由于研究技术的限制,PTPs的功能阐述以及与底物相互作用的解析尚浅,极限制了相关疾病治疗的进展。
图1 非天然氨基酸的设计及作用机制
在这篇文章中,作者设计通过PTPs和底物蛋白的共价交联反应机制,即利用PTPs对底物蛋白的识别和结合亲和性,拉近其活性位点半胱氨酸与底物特定磷酸化位点上的ncAAs的距离,从而促进两个氨基酸的化学反应形成共价交联复合体,捕获作用于已知底物蛋白磷酸化位点的未知PTPs(图1a, b),根据磷酸酶共价抑制剂结构及作用机理,合成设计了一系列具有不同反应活性的酪氨酸类似物,称为非天然氨基酸(noncanonical amino acids,简称ncAAs),如图1c所示。
磷酸酶和底物蛋白的共价交联反应首先在体外实验中得到了验证。在大肠杆菌中,将ncAAs通过基因密码子扩展技术被编码到底物蛋白ABL1特定磷酸化位点上,进行纯化及质谱验证,同时表达PTP家族蛋白SHP2的催化结构域。ABL1和SHP2在适当反应条件下,能够发生明显的共价交联反应,形成两分子复合物(图2a),说明该方法具有可行性。
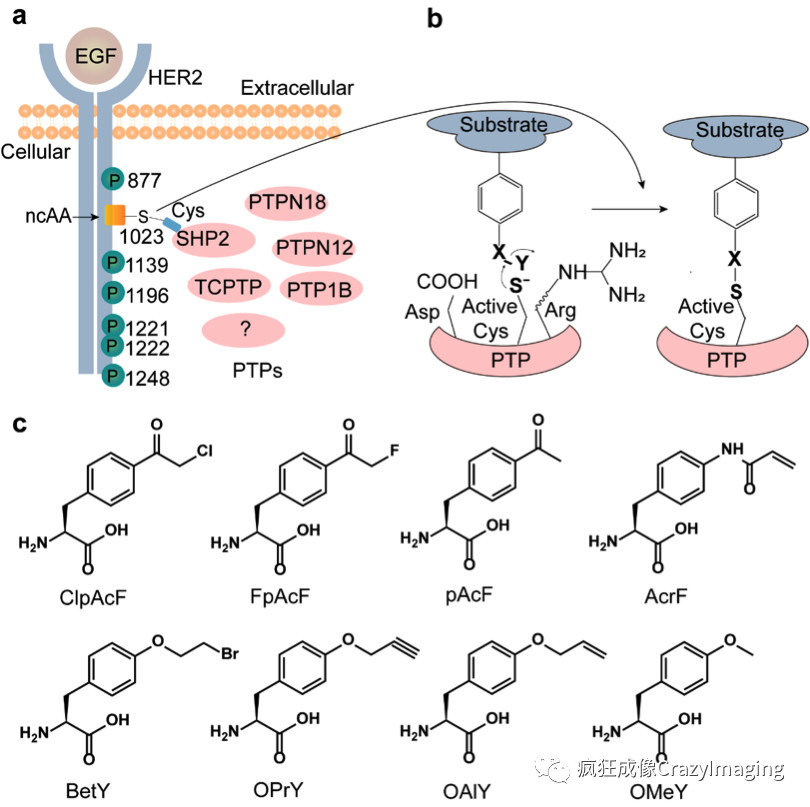
图2 共价交联反应在体外和细胞内的验证
进而,共价交联反应在活细胞中获得了验证。这些ncAAs都能有效的编码到真核细胞表达蛋白的特定位点(图2b),因此,以已知相互作用的SHP2和原癌基因人类表皮生长因子受体2(Human Epidermal growth factor Receptor 2,HER2)的磷酸化位点Y1023作为研究对象,利用该方法,通过免疫共沉淀和western blot检测,可以清楚的观测到SHP2-HER2两分子复合物,说明此方法可以用于验证底物蛋白和PTPs的相互作用。
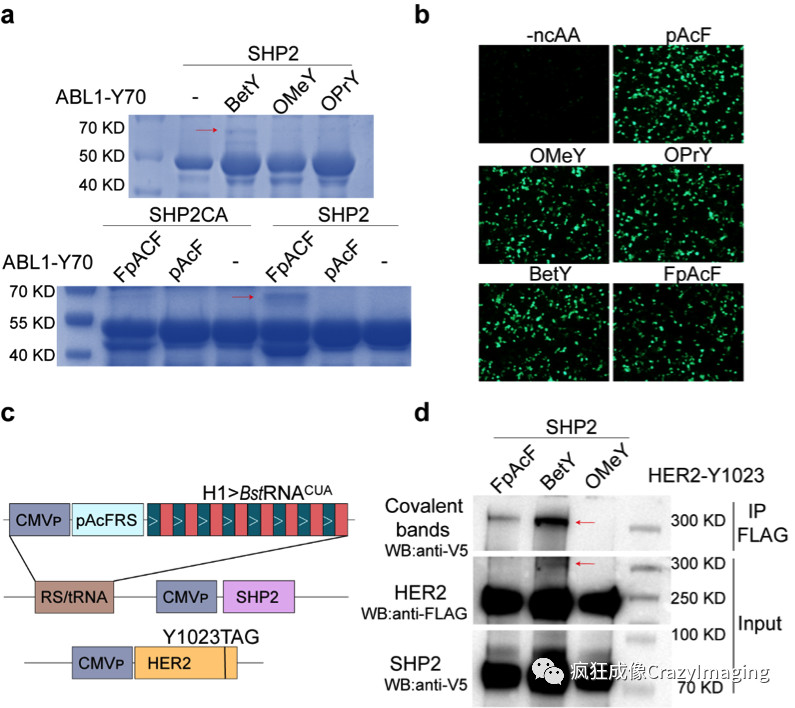
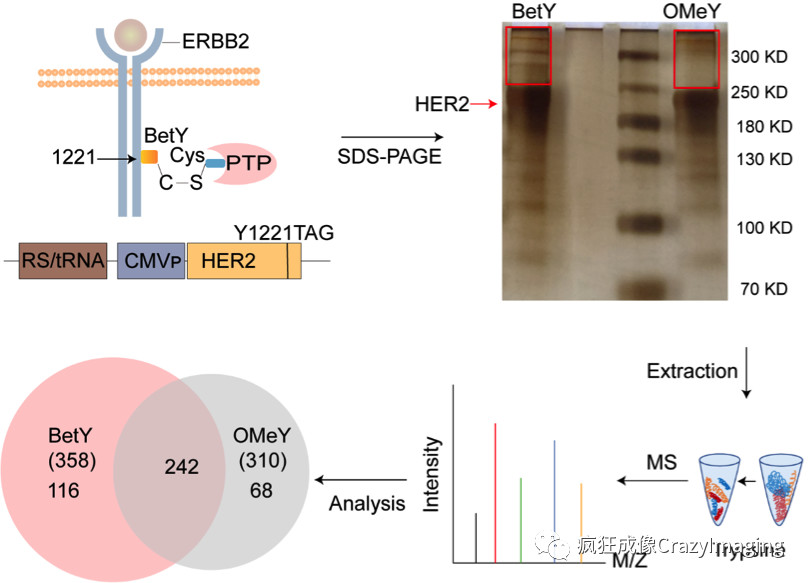
图3 底物特异性磷酸化酶的鉴定
最后,作者结合此方法和蛋白组学分析,建立了用于探索作用于已知底物蛋白的磷酸化位点的PTPs。以HER2的磷酸化位点Y1221为例,在活细胞中过表达在1221位点上带有ncAAs的HER2,裂解细胞进行免疫共沉淀,再通过SDS-PAGE分离出共价复合物,并通过蛋白组学分析,发现了催化该位点进行去掉磷酸基团的酶,即PTP1B (Protein Tyrosine Phosphatase 1B),这也是第一次对PTP1B与HER2直接相互作用的报道(图3)。
刘涛研究员,生于1982年。博士,博士生导师,天然药物及仿生药物国家重点实验室独立PI,北京大学药学院特聘研究员。北京大学百人计划,国家中组部青年千人计划入选者。发表科研论文20余篇,其中以第一作者或者通讯作者的身份在J Am Chem Soc, Cell Chem Biol, PNAS, Angew Chem, J Med Chem, ACS ChemBiol, 等一系列杂志上发表高水平论文14篇,申请国际专利两项。团队研究方向以蛋白大分子生物工程,化学修饰以及细胞的信号转导研究为主。研究团队运用化学生物学,合成生物学和转化医学的研究方法,以遗传密码子扩展技术和分子文库筛选技术为核心,突破大自然中蛋白质是由20种天然氨基酸所组成的局限,并将其应用到蛋白大分子制药和阐明疾病的发生发展机理领域,为生物药物的升级换代和开发新的治疗靶点奠定基础。