 国外新闻返回
国外新闻返回
LED光源-从显微成像到光遗传学研究
发布时间:2016-04-13 浏览量:3987由于LED被引入生物科学研究的显微镜照明,使研究小组和影像实验室有信心将其范围和潜力完全取代金属卤化物光源,合适的HBO弧光灯替代品一直是一个挑战。但随着最近推出的全光谱照明装置和更先进的系统,LED照明正在成为新的标准。

显微镜长期以来一直在生物科学研究中占据重要位置,可追溯到第一次观察
活细胞包括使用LED的技术已经开发 - 并且将继续 - 以满足研究人员新的和不断变化的需求。
生物科学显微镜
生物科学微拷贝中使用的技术可分为两个主要阵营:

活细胞包括使用LED的技术已经开发 - 并且将继续 - 以满足研究人员新的和不断变化的需求。
生物科学显微镜
生物科学微拷贝中使用的技术可分为两个主要阵营:
- 透射光,明视场显微镜,用于可视化染色的组织学样本或采用对比度方法,如相位对比度,微分干涉对比度和浮雕对比度;
- 反射光荧光显微镜

图1a,1b。明场显微镜图像描绘了染色载玻片(a)和迁移室(b)中细胞的相衬图像。
为了筛选染色组织(图1a)或对比技术,如相(图1b)或DIC,典型的研究实验室将使用配备12 V白炽钨卤灯(100 W)的显微镜设置为9 V,色温约为3200 K.虽然这是一种廉价而有效的设置,但LED光源正成为主要显微镜制造商的默认透射光源。LED具有与日光滤光器类似的显色指数,可提供出色的灵活性并集成到硬件和软件中。
LED照明已经成为明场显微镜的一种选择,但它在荧光显微镜领域却是如此
已经产生了最大的影响。直到最近十年,高压汞蒸气电弧放电灯才是氙气标准配置工作的替代品。大约在这个时候,LED成为荧光显微镜的一个选择。LED克服了很多
与弧光灯相关的问题,包括灯泡的重复更换和随后的对准,重启时间,启动后强度的波动以及随时间的强度下降。
克服汞和氙系统失效的能力并非如此
最初由LED制造商实现。对于需要单色或双色系统的研究人员而言,LED立即适用。然而,主流市场需要的是适合标准范围的荧光团(DAPI,FITC,TRITC,Cy5)的光源,以及使用Cy5.5,Cy7,CFP,YFP等的灵活性。终端LED系统有四个“固定”通道,确实找到了自己的位置,但没有达到预期的效果。
一般光源的作用由金属卤化物光源填充。卤化物灯泡持续了2000小时,重要的是它们比四通道LED装置提供更大的灵活性。卤化物源也有一些缺点。灯泡在显微镜开启的持续时间内点亮,而LED仅在短暂的采集期间点亮。一些卤化物光源的波动系数可以达到10%。
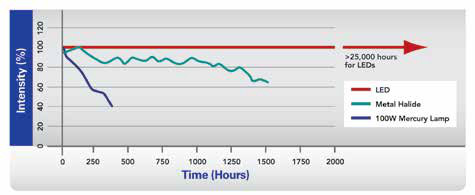
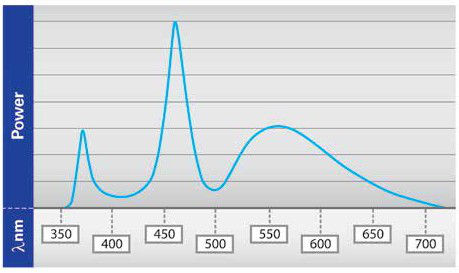
图2a,2b。与汞或卤化物光源相比,基于LED的光源的强度具有更好的寿命和强度稳定性(a)。光谱范围涵盖大多数技术中使用的大多数荧光团的峰值激发
卤化物光源本质上将UV和IR投射到光导上。由于UV和IR的降解,卤化物系统中的光导管需要在一段时间后更换。但LED对光导的危害较小,消除了任何退化。
为了产生影响,LED制造商需要一种能够在365到700纳米及更长时间内提供光谱照射的系统。通过组合多个波长生产有效的白光源,可直接替代用户现有的显微镜系统和滤光片立方体。这些还提供了额外的优势
0到100%的强度调整,随时间稳定的强度(图2a和2b),即时开/关和集成到软件中的机会。
白光LED照明系统应被视为金属卤化物和汞的经济有效替代品。
如上所述,主要制造商最初为更高级的例程构建了四色LED光源,包括多色,延时成像。与传统光源相比,它们具有许多优点,例如强度稳定性和速度。
在带有内部快门的标准延时显微镜系统中,快门将被打开,相机曝光被接合,然后每张照片的快门关闭。这仍然会使样品暴露在来自弧光灯的光下,使相机获取时间增加一倍,并可能导致光毒性和实验失败。
在实验中,始终建议从样本中的多个站点拍摄图像。这确保了图像作为整体代表样本。在某些情况下,很难访问统计所需的点数
实验方案中循环时间内的显着性。即使在简单的情况下,研究人员使用电动显微镜并自动更换旋转木马中的过滤器,颜色之间的切换时间可以在500到800毫秒之间,慢快门时间为200毫秒。为克服这一缺陷,一些显微镜制造商采用先进的弧光照明系统
快速内部快门(1 ms),以及相邻位置之间50 ms延迟的快速滤光轮和衰减器。但是,连续激活这些组件仍会增加时间开销并导致图像捕获速度变慢。为了加快成像速度,一些公司采用实时控制器来并行更换组件;这些系统增加的复杂性和成本使它们超出了标准研究实验室的范围。最初的四通道LED单元获得了成功
发光二极管
平面是几微米,使得这样小的焦平面易受焦点漂移的影响,这通常是由热膨胀和收缩引起的。
为了克服热漂移的挑战,有两种常见的方法:基于软件的算法和基于硬件的z校正。只要细胞被限制在相似的图像平面,软件程序就可以充分地保持焦点,但是可以被自由浮动的非粘附细胞混淆。在硬件漂移校正系统中,光沿物镜向后反射到检测器,实时监测并传递到显微镜Z驱动器中。无论细胞环境如何,这都将保持所需的焦点位置,并且对于诸如粘着斑形成或新的超分辨率技术(即PALM,STORM和GSD)的许多研究项目而言是至关重要的。
使用LED照明的先进技术
有一系列新兴技术传统上采用激光照射样品,但现在转向LED。一个例子是结构照明显微镜(SIM),一种宽视场技术,可以将衍射极限以外的横向分辨率提高一倍。这是通过将一系列图案顺序投影到样品上并捕获图像,然后进行后处理来实现的。用于产生图案的快速LED颜色切换和DMD(可变形镜装置)意味着与传统的结构化图案生成的机械方法相比可以实现高速。
直到最近,旋转盘共焦显微镜系统的特点是激光器

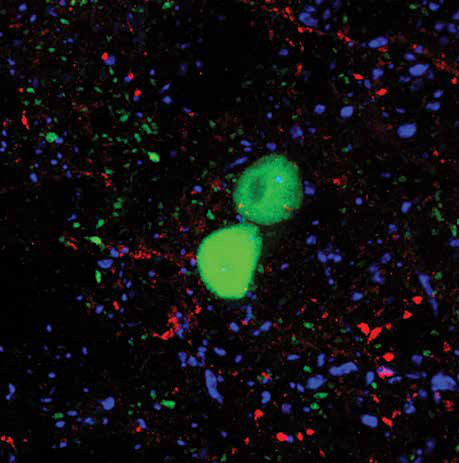
光遗传学
在神经科学中,长期以来一直希望选择性地靶向一种细胞类型进行研究而不影响样品中的其他细胞(图4)。部分地,这是在15年前通过使用Cre-Lox方法标记细胞来实现的,所述细胞瞬时表达已知对该细胞类型具有选择性的基因(图5)。然而,即使可以标记细胞类型,从单个细胞记录的方法在技术上具有挑战性或可能对组织有害,因此并不总是合适的。
随着2005年光遗传学的发展,克服了其中一些挑战。光遗传学将动作电位的光学调制与选择性靶标的遗传方法结合起来。
在异质群体中的单细胞类型,例如在脑组织中。它基于细菌视蛋白的修饰,细胞视蛋白是单个单元,光活化离子泵,其通过病毒载体选择性地递送到靶细胞中。根据所表达的离子通道,将聚焦光照射到细胞上将选择性地激活或抑制。
直到过去几年,激光仍然被认为是光学刺激,因为它们的光谱线宽窄,组织中的分散度低于非相干光源。然而,LED的FWHM较窄,最近功率/光输出增加(光纤末端100 mW / mm2,近似LED总功率的1%和LED的快速时间切换,“就光遗传学应用而言,LED在几乎所有方面都超过了激光器,”OpenOptogenet-ics表示(http://openoptogenetics.org/). 随着光遗传学协议变得更加标准化,并且在新研究实验室的能力范围内,LED光源也是如此对研究组来说越来越有吸引力的选择。
LED始终具有需要一个或两个波长的位置,其中不需要超过四种颜色的灵活性,或者速度是关键因素。然而,随着最近推出全光谱照明装置和更先进的系统,具有多达16个波长和快速触发,LED照明已成为新的标准。


为了筛选染色组织(图1a)或对比技术,如相(图1b)或DIC,典型的研究实验室将使用配备12 V白炽钨卤灯(100 W)的显微镜设置为9 V,色温约为3200 K.虽然这是一种廉价而有效的设置,但LED光源正成为主要显微镜制造商的默认透射光源。LED具有与日光滤光器类似的显色指数,可提供出色的灵活性并集成到硬件和软件中。
LED照明已经成为明场显微镜的一种选择,但它在荧光显微镜领域却是如此
已经产生了最大的影响。直到最近十年,高压汞蒸气电弧放电灯才是氙气标准配置工作的替代品。大约在这个时候,LED成为荧光显微镜的一个选择。LED克服了很多
与弧光灯相关的问题,包括灯泡的重复更换和随后的对准,重启时间,启动后强度的波动以及随时间的强度下降。
克服汞和氙系统失效的能力并非如此
最初由LED制造商实现。对于需要单色或双色系统的研究人员而言,LED立即适用。然而,主流市场需要的是适合标准范围的荧光团(DAPI,FITC,TRITC,Cy5)的光源,以及使用Cy5.5,Cy7,CFP,YFP等的灵活性。终端LED系统有四个“固定”通道,确实找到了自己的位置,但没有达到预期的效果。
一般光源的作用由金属卤化物光源填充。卤化物灯泡持续了2000小时,重要的是它们比四通道LED装置提供更大的灵活性。卤化物源也有一些缺点。灯泡在显微镜开启的持续时间内点亮,而LED仅在短暂的采集期间点亮。一些卤化物光源的波动系数可以达到10%。


图2a,2b。与汞或卤化物光源相比,基于LED的光源的强度具有更好的寿命和强度稳定性(a)。光谱范围涵盖大多数技术中使用的大多数荧光团的峰值激发
卤化物光源本质上将UV和IR投射到光导上。由于UV和IR的降解,卤化物系统中的光导管需要在一段时间后更换。但LED对光导的危害较小,消除了任何退化。
为了产生影响,LED制造商需要一种能够在365到700纳米及更长时间内提供光谱照射的系统。通过组合多个波长生产有效的白光源,可直接替代用户现有的显微镜系统和滤光片立方体。这些还提供了额外的优势
0到100%的强度调整,随时间稳定的强度(图2a和2b),即时开/关和集成到软件中的机会。
白光LED照明系统应被视为金属卤化物和汞的经济有效替代品。
如上所述,主要制造商最初为更高级的例程构建了四色LED光源,包括多色,延时成像。与传统光源相比,它们具有许多优点,例如强度稳定性和速度。
在带有内部快门的标准延时显微镜系统中,快门将被打开,相机曝光被接合,然后每张照片的快门关闭。这仍然会使样品暴露在来自弧光灯的光下,使相机获取时间增加一倍,并可能导致光毒性和实验失败。
在实验中,始终建议从样本中的多个站点拍摄图像。这确保了图像作为整体代表样本。在某些情况下,很难访问统计所需的点数
实验方案中循环时间内的显着性。即使在简单的情况下,研究人员使用电动显微镜并自动更换旋转木马中的过滤器,颜色之间的切换时间可以在500到800毫秒之间,慢快门时间为200毫秒。为克服这一缺陷,一些显微镜制造商采用先进的弧光照明系统
快速内部快门(1 ms),以及相邻位置之间50 ms延迟的快速滤光轮和衰减器。但是,连续激活这些组件仍会增加时间开销并导致图像捕获速度变慢。为了加快成像速度,一些公司采用实时控制器来并行更换组件;这些系统增加的复杂性和成本使它们超出了标准研究实验室的范围。最初的四通道LED单元获得了成功
发光二极管


平面是几微米,使得这样小的焦平面易受焦点漂移的影响,这通常是由热膨胀和收缩引起的。
为了克服热漂移的挑战,有两种常见的方法:基于软件的算法和基于硬件的z校正。只要细胞被限制在相似的图像平面,软件程序就可以充分地保持焦点,但是可以被自由浮动的非粘附细胞混淆。在硬件漂移校正系统中,光沿物镜向后反射到检测器,实时监测并传递到显微镜Z驱动器中。无论细胞环境如何,这都将保持所需的焦点位置,并且对于诸如粘着斑形成或新的超分辨率技术(即PALM,STORM和GSD)的许多研究项目而言是至关重要的。
使用LED照明的先进技术
有一系列新兴技术传统上采用激光照射样品,但现在转向LED。一个例子是结构照明显微镜(SIM),一种宽视场技术,可以将衍射极限以外的横向分辨率提高一倍。这是通过将一系列图案顺序投影到样品上并捕获图像,然后进行后处理来实现的。用于产生图案的快速LED颜色切换和DMD(可变形镜装置)意味着与传统的结构化图案生成的机械方法相比可以实现高速。
直到最近,旋转盘共焦显微镜系统的特点是激光器
在这些情况下取得了一些成功
没有必要将硬件快门,衰减器轮或滤光轮用于配备多波段二向色镜的显微镜。单个LED可以通过TTL触发在<1 ms内以所需强度打开,从而显着提高速度。
例如,当在装有弧光灯的电动显微镜中以50ms的相机曝光时间成像三种颜色时,每个位置的时间是
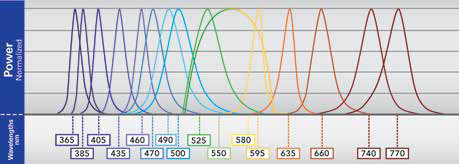
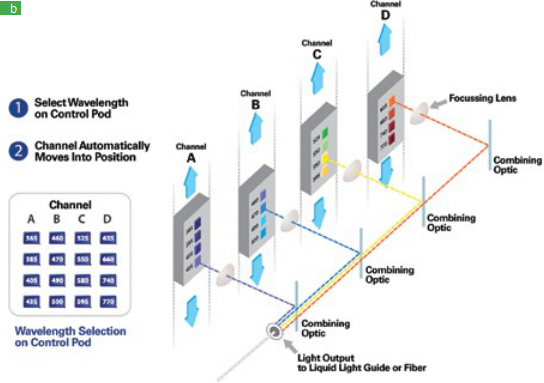
2到3秒,取决于组件的速度。对于配备多波段二向色的LED和显微镜,循环时间为151 ms。虽然高速系统速度更快,但LED可以显着超越它们。吸收的主要障碍是四线系统的相对不灵活性。现在,最新一代LED系统克服了这些问题,因为它们配备了多达16个波长(图3a和3b),跨越365nm到770nm,能够触发适合市场上主要四频滤波器立方体的LED组合。
它们现在已成为普通高速,延时成像以及下面提到的一些先进技术的照明系统。
焦点漂移校正
LED不仅用于在延时显微镜中照射样品。它们也用于大多数焦点漂移校正系统(来自制造商等)
如徕卡,尼康和蔡司),这是用于保持焦点的反馈设备。
在高倍率下,焦点对准
由于通过系统的光损失而发光。然而,现在LED更强大,它们被用在一些较便宜的系统中。
对于允许更多光传输的光盘,LED特别成功。LED已成为更便宜的替代方案的其他方法是TIRF显微镜,光动力疗法(其中光用于减少肿瘤),FRET(福斯特共振能量转移)用于确定蛋白质 - 蛋白质相互作用和钙成像。与最快的基于短弧光栅的系统相比,用于钙成像的LED已经变得普遍,因为其亚毫秒开关和更高的稳定性。以前,比例图像可以10 fps成像。LED的速度增加到100 fps。
没有必要将硬件快门,衰减器轮或滤光轮用于配备多波段二向色镜的显微镜。单个LED可以通过TTL触发在<1 ms内以所需强度打开,从而显着提高速度。
例如,当在装有弧光灯的电动显微镜中以50ms的相机曝光时间成像三种颜色时,每个位置的时间是
2到3秒,取决于组件的速度。对于配备多波段二向色的LED和显微镜,循环时间为151 ms。虽然高速系统速度更快,但LED可以显着超越它们。吸收的主要障碍是四线系统的相对不灵活性。现在,最新一代LED系统克服了这些问题,因为它们配备了多达16个波长(图3a和3b),跨越365nm到770nm,能够触发适合市场上主要四频滤波器立方体的LED组合。
它们现在已成为普通高速,延时成像以及下面提到的一些先进技术的照明系统。
焦点漂移校正
LED不仅用于在延时显微镜中照射样品。它们也用于大多数焦点漂移校正系统(来自制造商等)
如徕卡,尼康和蔡司),这是用于保持焦点的反馈设备。
在高倍率下,焦点对准
由于通过系统的光损失而发光。然而,现在LED更强大,它们被用在一些较便宜的系统中。
对于允许更多光传输的光盘,LED特别成功。LED已成为更便宜的替代方案的其他方法是TIRF显微镜,光动力疗法(其中光用于减少肿瘤),FRET(福斯特共振能量转移)用于确定蛋白质 - 蛋白质相互作用和钙成像。与最快的基于短弧光栅的系统相比,用于钙成像的LED已经变得普遍,因为其亚毫秒开关和更高的稳定性。以前,比例图像可以10 fps成像。LED的速度增加到100 fps。


光遗传学
在神经科学中,长期以来一直希望选择性地靶向一种细胞类型进行研究而不影响样品中的其他细胞(图4)。部分地,这是在15年前通过使用Cre-Lox方法标记细胞来实现的,所述细胞瞬时表达已知对该细胞类型具有选择性的基因(图5)。然而,即使可以标记细胞类型,从单个细胞记录的方法在技术上具有挑战性或可能对组织有害,因此并不总是合适的。
随着2005年光遗传学的发展,克服了其中一些挑战。光遗传学将动作电位的光学调制与选择性靶标的遗传方法结合起来。
在异质群体中的单细胞类型,例如在脑组织中。它基于细菌视蛋白的修饰,细胞视蛋白是单个单元,光活化离子泵,其通过病毒载体选择性地递送到靶细胞中。根据所表达的离子通道,将聚焦光照射到细胞上将选择性地激活或抑制。
直到过去几年,激光仍然被认为是光学刺激,因为它们的光谱线宽窄,组织中的分散度低于非相干光源。然而,LED的FWHM较窄,最近功率/光输出增加(光纤末端100 mW / mm2,近似LED总功率的1%和LED的快速时间切换,“就光遗传学应用而言,LED在几乎所有方面都超过了激光器,”OpenOptogenet-ics表示(http://openoptogenetics.org/). 随着光遗传学协议变得更加标准化,并且在新研究实验室的能力范围内,LED光源也是如此对研究组来说越来越有吸引力的选择。
LED始终具有需要一个或两个波长的位置,其中不需要超过四种颜色的灵活性,或者速度是关键因素。然而,随着最近推出全光谱照明装置和更先进的系统,具有多达16个波长和快速触发,LED照明已成为新的标准。









 QQ 501747125,
QQ 501747125,