 编辑推荐返回
编辑推荐返回
常见细胞流体剪切力实验类型及特征简要介绍
发布时间:2019-08-20 浏览量:3776
一. 流体剪切力细胞实验背景
液体是每个生物物种的重要组成部分。在生理状态下,许多细胞类型被流体环境包围。典型例子包括:血管内皮细胞,形成血管内层,淋巴管内皮细胞,形成淋巴管内层,肾和肺的上皮细胞。
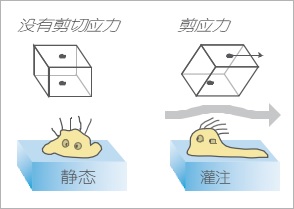
这种液体流动引起剪切应力,这是一种机械力,以多种方式影响细胞形态和行为。在许多标准体外实验中,细胞在没有流动的情况下培养。在这些静态条件下,通常没有考虑剪切应力依赖性细胞变化。实际上,在流动下的体外细胞培养并模拟这种机械刺激并诱导更加接近生理状态的体内生物过程行为很有意义。特别对于研究在生物流体中存在的细胞时,模拟流动状态显得尤其重要,如内皮细胞或上皮细胞。
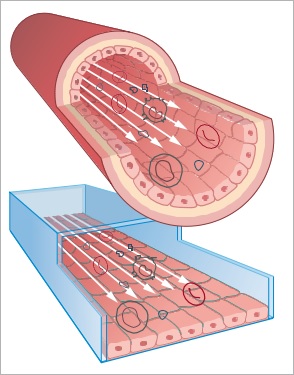
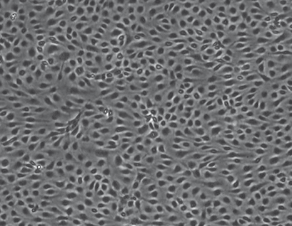
下图实验显示了静态和流动状态下人脐静脉内皮细胞(HUVEC)的免疫荧光图像,显示在流体环境和静止环境下细胞的不同状态。 用鬼笔环肽(红色)染色细胞骨架F-肌动蛋白。 VE-钙粘蛋白(绿色)标记粘附连接点。 使用DAPI(蓝色)染色细胞核。
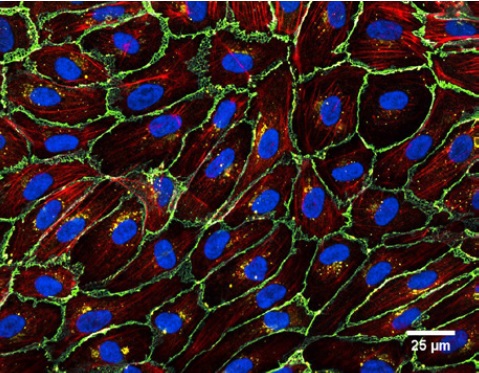
左:HUVEC,静态培养,0 dyn / cm, 2.5天, μ-slide 35mm培养皿。 右:HUVEC,流体剪切力10 dyn /cm²环境,2天,μ-Slide I 0.4 Luer.
二.流动剪切应力对细胞的影响
剪切应力是由液体对顶端细胞膜的摩擦引起的机械力。 在体内,几种贴壁细胞类型暴露于生物流体系统中的机械剪切应力,例如血液和淋巴管或肾单位。 这种机械刺激对细胞的生理行为和粘附特性有很大影响。 细胞通过离子通道激活,基因表达和整个细胞层的重组的变化对剪切应力起反应。
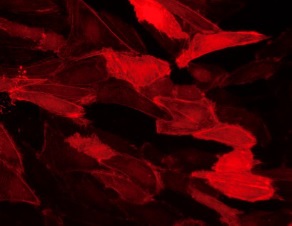
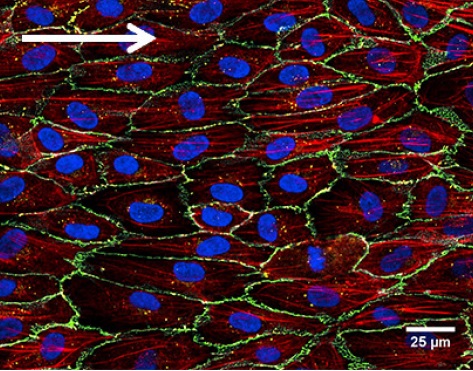
上图显示了HUVEC在流动条件下(20 dyn /cm²)培养 μ-SlideI 0.4 Luer 超过9天。 为了观察细胞骨架,用腺病毒载体转导细胞RAV巨细胞病毒-LifeAct-TagRFP 实验前24小时。
剪切应力以达因/平方厘米(dyn / cm 2)测量, 生理剪切应力值的范围为0.5至120达因/平方厘米,取决于血管类型(例如,动脉或静脉),组织(例如,脑,结缔组织或心脏),以及生物体的大小(例如,小鼠,大鼠或人)。
下图显示了常见组织细胞的剪切力范围:
| 组织类型 | 剪切应力(dyn /cm²) |
| 主动脉 | ~ 1–22 |
| 动脉 | ~ 10–70 |
| 静脉 | ~ 1–6 |
| 毛细血管 | ~ 3–95 |
三.不同类型的流动简要介绍
在不同的生物组织中,通常具有几种明确特征的几种流体类型。 基本上,流动类型可以细分为层流和湍流:
下面是我们整理的几种常见类型流体情况及特征;
| 流动类型 | 生理发生 | 流量 | 流动的方向 | 使用ibidi泵/载玻片生成 |
| 层流 | 在许多健康的血管中常见 | 是 | ||
| 单向层流 | 在大多数小型健康生物血管中 | 不变 | 不变 | 是 |
| 脉动层流 | 在大动脉血管中由于心跳引起的波动 | 定期更改 | 不变 | 是 |
| 振荡层流 | 接受作为使用流动室的湍流模拟的手段 | 不变 | 定期更改 | 是 |
| 湍流 | 罕见,在病理生理过程中 | 更改 | 更改 | 没有 |
1 . 层流类型
层流被定义为没有湍流的液体运动。 流体以平行层流动,它们之间没有中断。 层流可以细分为以下几种:

•单向层流
•脉动层流
•振荡层流
2 .单向层流
在大多数小的健康生物血管中遇到单向层流,例如小动脉和静脉。 在体内,某些细胞,例如内皮细胞和肾上皮细胞,经常暴露于流动。
在实验上,通过在低壁通道中灌注介质,并通过保持流动方向和速度随时间恒定来实现单向层流。
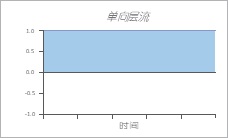
3 .非均匀层流
单向层流可以以不均匀的图案发生。 这里,流动方向是恒定的,而流速在细胞层上空间变化。 在体内,在血管分支部位发生不均匀的层流。 在实验上,非均匀层流剪切应力可以通过特殊的通道几何形状来实现,其在载玻片内的特定位置处产生流速变化。微型μ-Slide Y形载玻片,已被设计用于研究非均匀流动的使用 ibidi泵系统 。 剪切应力水平取决于Y-形玻片的不同区域。
4 .脉动层流
由于心跳引起的波动,在大动脉血管中遇到脉动层流。 实验上,这种类型的流动可以通过采用具有周期性变化的流速和恒定流动方向的流动来模拟。
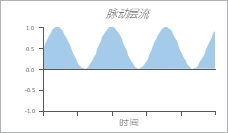
5 .振荡层流
振荡层流用作模拟湍流的手段。 流动方向以固定间隔改变。 除了阀门切换时,流量也是恒定的。

6 . 湍流
湍流的特征在于流速和方向随时间的不可预测的变化。 在体内,湍流很少见,只能在病理生理过程中发现。

四.数据来源及参考文献
1. C.P. Cheng, R.J. Herfkens, C.A. Taylor. Comparison of abdominal aortic hemodynamics between men and women at rest and during lower limb exercise. J Vasc Surg, 2003, 10.1067/mva.2002.107
2. C.P. Cheng, R.J. Herfkens, C.A. Taylor. Abdominal aortic hemodynamic conditions in healthy subjects aged 50-70 at rest and during lower limb exercise: in vivo quantification using MRI. Atherosclerosis, 2003, 168(2):323–31
3. A.M. Malek, S.L. Alper, S. Izumo. Hemodynamic shear stress and its role in atherosclerosis. JAMA, 1999, 282(21):2035–42
4.A.G. Koutsiaris, et al. Volume flow and wall shear stress quantification in the human conjunctival capillaries and post-capillary venules in vivo. Biorheology, 2007, 44(5–6):375–86







 QQ 501747125,
QQ 501747125,