 精品推荐返回
精品推荐返回
趋化性癌细胞迁移的准确跟踪——转移的基本见解
发布时间:2021-12-28 浏览量:1692介绍:
在全球范围内,癌症每年造成约 1000 万人死亡。1与癌症相关的死亡的主要原因不是原发肿瘤,而是癌症转移:恶性细胞侵入原发肿瘤以外的组织并在这些组织中扩散1,基础癌症研究是世界卫生组织降低癌症死亡率1战略的关键因素之一,研究转移的潜在机制可为主要临床问题提供重要信息。
在癌症转移中,单细胞的迁移在很大程度上受化学线索的影响,化学线索通过趋化性2为细胞迁移提供方向:单细胞沿着化学引诱物的浓度梯度迁移。3已经描述了各种化学引诱物用于通常研究的细胞系。据报道,HeLa 细胞(宫颈癌细胞)向更高浓度的纤维连接蛋白4和基质细胞衍生因子 1α 迁移。5已描述大鼠神经胶质瘤细胞系 C6 被缓激肽吸引。6包含所有上述化学引诱剂分子的细胞培养中常用的培养剂是胎牛血清 (FBS;未出生小牛的血清)。7-9因此,FBS 为化学线索提供了一个有趣且直接的模型系统提供给癌细胞。
然而,为了研究癌细胞对化学线索的反应,需要在具有化学引诱剂梯度的环境中进行准确的细胞追踪。已经进行了多种细胞培养容器设计,向细胞10-12提供趋化梯度,对细胞成像和监测。
这些血管中的细胞可以提供实际问题。目前,最常用的活细胞成像装置是具有足够放大倍数的显微镜和用于调节培养条件的台面培养箱。虽然这些显微镜具有精确成像和细胞跟踪所需的光学特性,但在使用这种设置进行活细胞成像时存在实际问题。与专用培养箱相比,培养箱中培养条件的调节对变化更敏感。13,14此外,图像仅在某些时间点捕获,但显微镜无法用于其他用户在此期间的(端点)成像整个实时成像实验。可以克服这些问题的系统是 CytoSMART® Lux3 BR Duo 试剂盒。这种用于活细胞成像的专用系统适用于常规培养箱,因此可以在恒定和最佳的培养环境中进行培养监测。 这些设备的光学特性提供了高质量的成像,以及准确的细胞追踪。通过将同一培养箱内的两个设备连接到一台笔记本电脑,可以同时监测和比较两种培养物,而无需为其他实验室成员占用显微镜。
在这项概念验证研究中,我们使用并排的高质量活细胞成像来确定 FBS 梯度对癌细胞系定向迁移的影响。使用ibidi µ-Slide Chemotaxis, CytoSMART® Lux3 BR Duo Kit 用于监测暴露于 FBS 梯度或恒定 FBS 浓度的两种癌细胞系。随着时间的推移跟踪细胞,这提供了对癌细胞趋化迁移的基本见解,这可能最终与癌症转移有关。
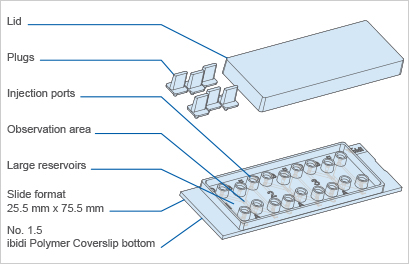
ibidi 80326
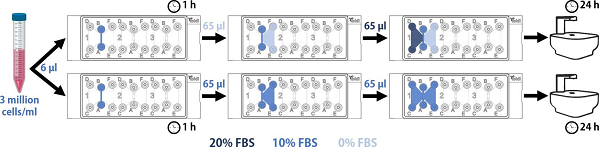
图 1:实验设置。将癌细胞系接种在 Ibidi µ-Slide Chemotaxis 中并添加培养基,从而产生 FBS 梯度或恒定 FBS 浓度。使用 CytoSMART® Lux3 BR Duo 试剂盒监测培养物 24 小时,成像间隔为 5 分钟。
材料和方法:
在标准培养条件下,将 HeLa 细胞(Innoprot P20107)和 C6 细胞(ATCC CCL-107)在补充有 10% FBS (Gibco) 和 1% pen-strep (Gibco) 的 DMEM (Gibco) 中培养至亚融合 (37 °C;5% CO2)。每个癌细胞系以每通道 18,000 个细胞(6 µl 细胞悬浮液;300 万个细胞/ml;含 10% FBS 的培养基)接种在 Ibidi µ-Slide Chemotaxis 中。将 65 µl 培养基(DMEM、FBS、pen-strep)添加到两边水库中:一个水库中的 20% FBS 和另一个水库中的 0% FBS 或两个水库中的 10% FBS(图 1)。使用 CytoSMART® Lux3 BR Duo 试剂盒(37°C;5% CO2)制作培养物的高质量图像:监测培养物 24 小时,每 5 分钟拍摄一次快照。然后,从 CytoSMART® Cloud 导出图像,并使用 FIJI 插件 TrackMate 跟踪单个细胞。15使用 FIJI 插件 Chemotaxis 和迁移工具将跟踪的路径转换为趋化图。16
结果:
图 2(HeLa 细胞)和图 3(C6 细胞)中显示了具有 FBS 梯度或恒定 FBS 浓度的培养物的延时图像。HeLa 细胞在恒定 FBS 浓度下从它们的起源迁移了更远的距离,但表现出略微倾向于向更高的迁移暴露于梯度时的 FBS 浓度。在恒定的 FBS 浓度下,C6 细胞似乎从原点迁移的距离更小。然而,这些细胞在 FBS 梯度中也显示出较少的定向迁移 - 因此没有明显的趋化迁移。

图 2:HeLa 细胞在恒定 FBS 浓度下迁移更大的距离,但在暴露于梯度时更倾向于向更高的 FBS 浓度迁移。A) 使用 CytoSMART® Lux3 BR Duo Kit 制作的 HeLa 细胞原始图像,使用 FIJI 插件 TrackMate 进行单细胞检测(紫色)和路径检测(黄色)。B) 使用 FIJI 插件趋化性和迁移工具可视化的 HeLa 细胞的趋化位移,纵向和横向位移相对于 FBS 梯度定义。
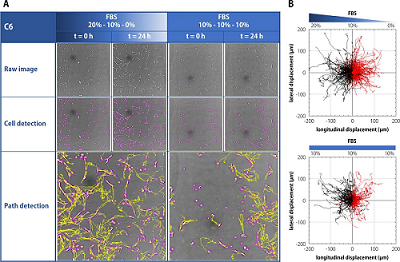
图 3:C6 细胞在 FBS 梯度中没有显示出明显的趋化迁移。A) 使用 CytoSMART® Lux3 BR Duo 试剂盒制作的 C6 细胞原始图像,使用 FIJI 插件 TrackMate 进行单细胞检测(紫色)和路径检测(黄色)。B) 使用 FIJI 插件趋化性和迁移工具可视化的 C6 细胞的趋化位移,纵向和横向位移相对于 FBS 梯度定义。
讨论:
癌症转移是癌症相关死亡的主要原因,因此细胞迁移是癌症研究的重要课题。高质量的活细胞成像是准确细胞追踪的先决条件,它提供了对驱动转移性细胞迁移机制的基本见解。这些机制之一是趋化性,其中细胞沿着趋化剂的梯度增加迁移。本研究旨在通过 ibidi µ-Slide Chemotaxis和CytoSMART® Lux3 BR Duo 试剂盒使用并排高质量活细胞成像来确定 FBS 梯度对癌细胞系定向迁移的影响。这些设备提供了可立即应用于分析软件的高质量图像,从而实现轻松准确的单细胞跟踪。从该跟踪中可以看出,HeLa 细胞更倾向于向更高的 FBS 浓度迁移,而 C6 细胞则不太清楚。
宫颈癌是最常见的转移性原发肿瘤之一,转移灶见于例如骨、肝和肺组织。17胶质瘤转移是一种非常罕见的现象。18,19这些转移中的每一个的临床患病率都可能与血清的多少有关 - 在本研究中由 FBS 建模– 作为细胞的化学引诱剂。由于通过血流扩散是转移17的主要机制,因此肿瘤细胞向血管的定向迁移和可能的趋化迁移可引发转移。与神经胶质瘤细胞系 C6 相比,在本研究中显示出更多趋化迁移的宫颈癌细胞系 HeLa 似乎与相应转移的临床患病率一致。
在本研究中用作化学引诱剂的 FBS 提供了一个实验上简单的模型系统。除此之外,这种设置模拟了向血管的定向迁移。然而,FBS 具有可变且复杂的组成 20,因此对负责所研究细胞定向迁移的特定分子几乎没有提供任何了解。还应考虑到 FBS 具有除趋化迁移外影响细胞行为的其他特性:例如,细胞培养物中的 FBS 浓度会影响细胞增殖。21尽管在高 FBS 浓度和低 FBS 浓度下增殖率没有明显差异观察到,细胞迁移可能仍然受到其他 FBS 相关过程的影响。因此,在相同设置下的后续实验,使用单个化学引诱剂可以提供有关细胞行为的更详细信息。
结论:
在这项研究中,我们成功地展示了使用高质量活细胞成像进行准确细胞追踪的可能性。 ibidi µ-Slide Chemotaxis,CytoSMART® Lux3 BR Duo Kit 能够并行监测实验条件,并提供直接适用于细胞追踪的图像。这揭示了趋化性。
HeLa 细胞在 FBS 梯度中的迁移,而 C6 细胞没有显示出明显的趋化迁移。高质量的成像和相应的结果最终可能与癌症转移的基础研究相关。
参考文献:
[1] World Health Organization (2021). Fact sheet: Cancer. Retrieved from: https://www.who.int/news-room/fact-sheets/detail/cancer.
[2] Roussos ET, Condeelis JS, Patsialou A (2011). Chemotaxis in cancer. Nat Rev Cancer, 11(8), 573-587.
[3] Iijima M, Huang YE, Devreotes P (2002). Temporal and spatial regulation of chemotaxis. Dev Cell, 3(4), 469-478.
[4] Sugihara K, Saito T, Okadome M, Sonoda K, Kobayashi H, Kamura T, Tsukamoto N, Nakano H (1994). The promotion of invasion
through the basement membrane of cervical carcinoma cells by fibronectin as a chemoattractant. Cancer Lett, 79(2), 167-173.
[5] Sun Y, Cheng Z, Ma L, Pei G (2002). β-Arrestin2 is critically involved in CXCR4-mediated chemotaxis, and this is mediated by its enhancement of p38 MAPK activation. J Biol Chem, 277(51), 49212-49219.
[6] Montana V, Sontheimer H (2011). Bradykinin promotes the chemotactic invasion of primary brain tumors. J Neurosci, 31(13),
4858-4867.
[7] Hayman EG, Ruoslahti E (1979). Distribution of fetal bovine serum fibronectin and endogenous rat cell fibronectin in extracellular matrix. J Cell Biol, 83, 255-259.
[8] Marques CS, Soares M, Santos A, Correia J, Ferreira F (2017). Serum SDF-1 levels are a reliable diagnostic marker of feline mammary carcinoma, discriminating HER2-overexpressing tumors from other subtypes. Oncotarget, 8(62), 105775.
[9] Zhou Y, Wang W, Wei R, Jiang G, Li F, Chen X, Wang X, Long S, Ma D, Xi L (2019). Serum bradykinin levels as a diagnostic marker in cervical cancer with a potential mechanism to promote VEGF expression via BDKRB2. Int J Oncol, 55(1), 131-141.
[10] Guy JB, Espenel S, Vallard A, Battiston-Montagne P, Wozny AS, Ardail D, Alphonse G, Rancoule C, Rodriguez-Lafrasse C, Magne, N. (2017). Evaluation of the cell invasion and migration process: a comparison of the video microscope-based scratch wound assay and the boyden chamber assay. J Vis Exp, 129, e56337.
[11] Nogalski MT, Chan GC, Stevenson EV, Collins-McMillen DK, Yurochko ADA (2012). Quantitative evaluation of cell migration by the phagokinetic track motility assay. J Vis Exp, 4(70), e4165.
[12] Chen Y-C, Allen SG, Ingram PN, Buckanovich R, Merajver SD, Yoon E (2015). Single-cell migration chip for chemotaxis-based microfluidic selection of heterogeneous cell populations. Sci Rep, 5, 9980.
[13] Frigault MM, Lacoste J, Swift JL, Brown CM (2009). Live-cell microscopy–tips and tools. J Cell Sci, 122(6), 753-767.
[14] Ettinger A, Wittmann T (2014). Fluorescence live cell imaging. Methods Cell Biol, 123, 77-94.
[15] Tinevez J-Y, Perry N, Schindelin J, Hoopes GM, Reynolds GD, Laplantine E, Bednarek SY, Shorte SL, Eliceiri KW (2017). TrackMate: An open and extensible platform for single-particle tracking. Methods, 115, 80–90.
[16] Ibidi (n.d.). Chemotaxis and Migration Tool. Retrieved from: https://ibidi.com/chemotaxis-analysis/171-chemotaxis-andmigration-tool.html.
[17] NIH – National Cancer Institute (2020). Metastatic Cancer: When Cancer Spreads. Retrieved from: https://www.cancer.gov/
types/metastatic-cancer.
[18] Alvord EC (1976). Why do gliomas not metastasize?. Arch Neurol, 33(2), 73-75.
[19] Lun M, Lok E, Gautam S, Wu E, Wong ET (2011). The natural history of extracranial metastasis from glioblastoma multiforme.
J Neurooncol., 105(2), 261-273.
[20] van der Valk J, Bieback K, Buta C, Cochrane B, Dirks W, Fu J, Hickman JJ, Hohensee C, Kolar R, Liebsch M, Pistollato F, Schulz M, Thieme D, Weber T, Wiest J, Winkler S, Gstraunthaler G (2018). Fetal bovine serum (FBS): past–present–future. Altex, 35, 99-118.
[21] Ibrahim B, Stange J, Dominik A, Sauer M, Doss S, Eggert M (2020). Albumin promotes proliferation of G1 arrested serum starved hepatocellular carcinoma cells. PeerJ, 8, e8568.







 QQ 501747125,
QQ 501747125,